微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 室温下,水溶液体系中的化学反应I— + OCl— = OI— + Cl—的反应物初始浓度、溶液中的OH—初始浓度及初始速率间的关系如下表所示:
实验
编号
| I—的初始浓度
(mol·L-1)
| OCl—的初始浓度
(mol·L-1)
| OH—的初始浓度
(mol·L-1)
| 初始速率v
(mol·L-1· s-1)
|
1
| 2 × 10–3
| 1.5 × 10–3
| 1.00
| 1.8 × 10–4
|
2
| a
| 1.5 × 10–3
| 1.00
| 3.6 × 10–4
|
3
| 2 × 10–3
| 3 × 10–3
| 2.00
| 1.8 × 10–4
|
4
| 4 × 10–3
| 3 × 10–3
| 1.00
| 7.2  × 10–4 × 10–4
|
已 知表中初始反应速率与有关离子浓度关系可以表示为v=" k" [I—?]1 [OCl—]b [OH—]c(温度一定时,k为常数)。
知表中初始反应速率与有关离子浓度关系可以表示为v=" k" [I—?]1 [OCl—]b [OH—]c(温度一定时,k为常数)。
(1)为开展实验1,某同学取5mL0.02mol·L-1碘化钾溶液、5mL0.015 mol·L-1次氯酸钠溶液、40mL某浓度氢氧化钠溶液混合反应。则该氢氧化钠溶液物质的量浓度为?;
(2)实验2中,a="?" ;
(3)设计实验2和实验4的目的是?;
(4)计算b、c值:b="?" ;c = ?;
= ?;
(5)若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v="?" 。
参考答案:

本题解析:略
本题难度:简单
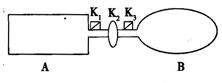
2、填空题 21.(8分)下图装置中,A是由导热材料制成的密闭容器,B是耐化学腐蚀且易于传热的透明气球,关闭K2,将等量且少量的NO2通过K1、K3分别充A、B中,反应起始时,A、B的体积相同均为a L。已知:2NO2(g) 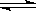 N2O4(g)
N2O4(g) 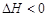

参考答案:(3)2NO2(g) 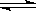 N2O4(g)
N2O4(g)
始 1 0
转 2x x
平 1-2x x
则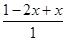 =0.8 解得x=0.2mol v=0.2×2/at=
=0.8 解得x=0.2mol v=0.2×2/at=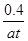 mol·L-1·s-1
mol·L-1·s-1
(4)打开K2,相当于是在等温等压时的平衡,因此平衡是等效的,由于此时反应物的物质的量是B中的2倍,所以打开K2之前,气球B体积为(aL+0.4L)/2=0.7aL
本题解析:(1)将等量且少量的NO2通过K1、K3分别充A、B中,反应起始时,A、B的体积相同均为a L。已知:2NO2(g) 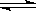 N2O4(g)
N2O4(g) 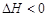 ,NO2是红棕色气体,当达到平衡时气体的颜色不再发生变化;(2)平衡后再向A中冲入0.5molN2O4,相当于增大了压强,平衡正向移动,NO2的百分含量会减小;
,NO2是红棕色气体,当达到平衡时气体的颜色不再发生变化;(2)平衡后再向A中冲入0.5molN2O4,相当于增大了压强,平衡正向移动,NO2的百分含量会减小;
考点:化学平衡
点评:本题考查了化学平衡的计算等知识点,难点是根据等效平衡进行计算,难度较大。
本题难度:困难
3、选择题 在一定温度时,将1mol A和2mol B放入容积为5 L的某密闭容器中发生如下反应:A(s)+2B(g) C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol·L-1。则下列叙述不正确的是(?)
C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol·L-1。则下列叙述不正确的是(?)
A.在5min内该反应用C的浓度变化表示的反应速率为
0.02mol·(L·min)-1
B.在5min时,容器内D的浓度为0.2mol·L-1
C.该可逆反应随反应的进行,容器内压强逐渐增大
D.5min时容器内气体总的物质的量为3mol
参考答案:D
本题解析:根据题意,可以计算v(B)=0.04mol·(L·min)-1,则v(C)=0.02mol·(L·min)-1,A正确。5min时,c(C)=0.1mol·L-1,则c(D)=0.2mol·L-1,B正确。该反应为气体物质的量增加的反应,随反应的进行,容器内压强增大,C正确。5min时,Δn(B)=0.2mol·L-1×5 L=1mol,Δn(C)=0.5mol,Δn(D)=1mol。因此气体的物质的量为2mol-1mol+0.5mol+1mol=2.5mol,D说法错误。
本题难度:一般
4、计算题 将对H2相对密度为3.6 的N2与H2组成的混合气0.5 mol 通入一恒容密闭容器中,一定条件下发生反应,平衡时容器内压强比反应前少了24%。求:
(1) 反应前混合气中N2和H2的质量比。
(2) 平衡混合气中,含氨的体积分数。
(3) 平衡时N2、H2的转化率。
参考答案:(1)7∶2(2)31.6%。
(3)N2、H2的转化率分别为60%和40%。
本题解析:这种题首先要利用相对密度求出混合气的平均相对分子量为 7.2,利用十字交叉法求出N2、H2的物质的量比为1∶4,从而得出N2、H2的质量比为 7∶2。然后设未知数列出下列平衡计算模式:
N2(g)?+? 3H2(g)?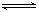 ?2NH3(g)
?2NH3(g)
n 0(mol)?0.4?+? 0.1?+? 0?=? 0.5
n变(mol)? 3x?x? 2x
n平(mol) ?0.4-3x?+? 0.1-x?+?2x?=? 0.5-2x
根据压强与物质的量成正比,可得出2x = 0.12 mol,即可求出NH3的体积分数为31.6%。最后可求出N2、H2的转化率分别为60%和40%。
本题难度:一般
5、填空题 (8分)如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:
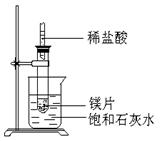
(1)实验中观察到的现象是
。
(2)产生该现象的原因
(3)写出有关反应的离子反应方程式
(4)由此推知,MgCl2溶液和H2的总能量 填(“大于”“小于”或“等于”)镁片和盐酸的总能量
参考答案:(1)向镁片表面产生气泡,逐渐减少;烧杯中有固体物质析出.
(2)镁跟盐酸反应产生氢气,并放出热量;Ca(OH)2的溶解度随温度的升高而变小.
(3)Mg+2H+
本题解析:
本题难度:一般