微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列陈述I、II正确并且有因果关系的是( )
| 选项 | 陈述I | 陈述II
A
浓H2SO4有吸水性
浓H2SO4可用于干燥氨气
B
SO2有氧化性
SO2尾气可用NaOH溶液吸收
C
Mg有还原性
电解MgCl2饱和溶液可制备Mg
D
锌金属活动性比铁强
海轮外壳上装锌块可减缓腐蚀
|
A.A
B.B
C.C
D.D
参考答案:D
本题解析:
本题难度:简单
2、选择题 含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(离子(或物质)沉淀pH见下表)
离子
| Mg2+
| Al 3+
| 物质
| Al(OH)3
|
开始沉淀pH
| 8.93
| 3.56
| 开始溶解pH
| 8.04
|
完全沉淀pH
| 10.92
| 4.89
| 完全溶解pH
| 12.04
|
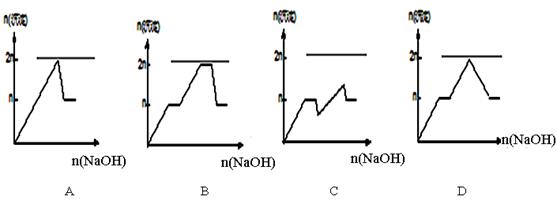
参考答案:C
本题解析:根据Mg2+、Al3+开始沉淀时的pH值可知,向MgCl2、AlCl3的混合溶液中滴NaOH溶液首先是氢氧化铝开始沉淀,当氢氧化铝开始溶解时Mg2+还没有开始形成沉淀。当pH=8.93时Mg2+开始形成沉淀,当pH=10.92时Mg2+完全沉淀此时氢氧化铝还没有完全溶解。当pH超过12.04时氢氧化铝完全溶解,因此符合反应过程的图像应该是C,答案选C。
本题难度:一般
3、填空题 下图是传统的工业生产金属铝的基本流程图,结合铝生产的流程图解答下列各题:

(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是__________(填化学式)。石油炼制和煤的干馏产品__________(填物质名称)作电解铝的阴极和阳极材料。
(2)氧化铝熔点高达2 050 ℃,工业上为了降低能量消耗,在金属铝的冶炼中采取的措施是_________________________________________________。
(3)在冶炼过程中,阳极材料需要定期地进行更换,原因是该极材料不断被消耗,产生这种现象的原因是: ____________________________(用化学方程式表示)。
(4)工业上制取金属镁时是电解熔融MgCl2,电解反应方程式为____________________________,镁和铝都是活泼金属,为什么在电解冶炼过程中,一个用氯化物,一个用氧化物_____________________。
参考答案:(1)Al2O3 碳素材料
(2)加入冰晶石(Na3AlF6)和少量CaF2
(3)C+O2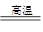 ?CO2
?CO2
(4)MgCl2(熔融)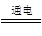 ?Mg+Cl2↑
?Mg+Cl2↑
因为MgO熔点太高,MgCl2熔点低,电解MgCl2耗能少。AlCl3是共价化合物,熔化时不能发生电离
本题解析:该题以工业冶炼金属铝为载体考查了原料的判断、原理的诠释以及能
量的合理利用。
(1)铝土矿的主要化学成分是Al2O3,另外还有SiO2、Fe2O3、TiO2、H2O等,电解前必须进行提纯。石油炼制、煤的干馏的固体物质的成分为碳,具有导电性,可以作为阳极和阴极材料。
(2)纯净Al2O3的熔点很高,而其电解必须在熔融状态下进行,若采用纯净的Al2O3进行电解,则加热熔融需要耗费大量的能量,所以工业上采用加入冰晶石(Na3AlF6)和氟化钙(CaF2)助熔。
(3)工业冶炼铝的关键操作是电解,电解时阳极发生氧化反应,熔融物中的O2-失电子,生成O2,在电解过程中阳极的材料碳逐渐与生成的氧气反应,在高温条件下生成CO2。
(4)因为MgCl2为离子化合物,熔融时能发生电离;AlCl3为共价化合物,熔融时不发生电离;再者MgO熔点很高,很难熔化,耗能太大。
本题难度:一般
4、填空题 下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题
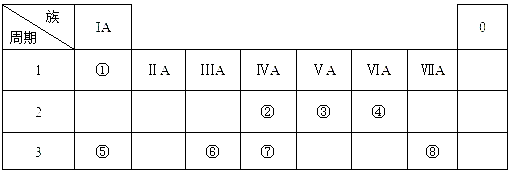
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是______________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应
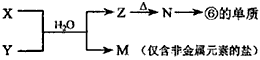
X溶液与Y溶液反应的离子方程式为_____________________, N→⑥的单质的化学方程式为
________________。
参考答案:(1)Na>Al>O
(2)HNO3>H2CO3>H2SiO3
(3)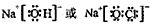
(4)ab
(5)Al3++3NH3·5H2O==Al(OH)3↓+3NH4+;2Al2O3(熔融) 4Al+3O2↑
4Al+3O2↑
本题解析:
本题难度:一般
5、实验题 SiO2、SO?2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性。某兴趣小组用如图所示装置进行Mg与SO2反应的实验。
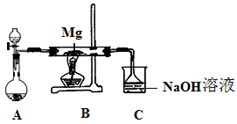
(1)选择制取SO2的合适试剂?(填编号)。
①浓HCl?②浓H2SO4?③Na2SO3固体?④CaSO3固体
(2)上述装置还可优化,优化的方法是?,装置C中NaOH溶液的作用是?。
(3)甲同学推测Mg与SO2的反应与CO2相似,则该反应方程式为?
?;乙同学的推测是:2Mg+3SO2 2MgSO3+S;丙同学的推测是:3Mg+SO2
2MgSO3+S;丙同学的推测是:3Mg+SO2 2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;H2S气体通入CuSO4溶液中出现黑色沉淀。
限选试剂:2mol/L HCl、2mol/L HNO?3、蒸馏水、2mol/LNaOH、品红溶液、澄清石灰水、2mol/LCuSO4;仪器和用品自选。
序号
| 实验步骤
| 预期现象和结论
|
①
| 取少量反应后所得固体于试管中
| ?
|
②
| 向试管中的固体慢慢滴加?,
试管口塞上带导管的单孔塞,并将导管通入盛有?的试管中。
| 若试管中的?,
则丙同学推测正确。
若试管中的固体未完全溶解,且??,则乙同学推测正确。
|
根据上述实验探究,能证明甲同学推测正确的操作和预期现象是?。
(4)上述实验需要100mL,2mol/L的HCl,配制时选用?(选填10 mL、25 mL、50 mL或100 mL)量筒量取36.5%,密度1.19g/mL的浓盐酸的体积为?mL。(保留三位有效数字)
参考答案:(16分)
(1)②③(2分)(有错不给分)
(2)在A和B之间增加用浓硫酸干燥的装置(2分);(或在B管药品下垫钢片也给2分)
(若有BC之间加用浓硫酸干燥的装置不算给分或扣分点,没有说明AB之间得0分)
吸收多余的SO2,防止污染环境(1分)
(只写其中一个就给1分,有错不给分)
(3)2Mg+SO2 2MgO+S(2分)
2MgO+S(2分)
(没写条件扣1分,条件可以写点燃,没有配平扣1分)
方案I
②
2mol/L 盐酸至过量(1分);
(盐酸没写浓度、没有写过量或足量不给分)
品红(1分)(或品红溶液)
固体完全溶解;(1分)
(没有写完全不给分)
(另加品红不褪色不算得分点)
品红溶液褪色(1分);(若只写品红也给分)
?
方案II
②
2mol/L 盐酸至过量(1分);
1~2ml(体积不算给分点)2mol/LCuSO4(1分)
出现黑色沉淀;(1分)(没有写黑色不给分)
有刺激性气味的气体产生(1分);
?
向反应后所得固体加过量2mol/L盐酸(写2mol/L硝酸不扣分)(给1分),固体未完全溶解且品红溶液不褪色(两个现象都对才给1分)(或反应后固体未完全溶解于盐酸且无气体产生(两个现象都对才给1分))(2分)
或者向反应后所得固体加过量2mol/LHCl(1分),固体未完全溶解且盛有2mol/LCuSO4的试管没有出现明显变化。(1分)前后答案不牵制,各得各的分
(4)25mL(1分)(有错不给分);16.8(16.7~17.0 都给2分,若只写17扣1分) (2分)
本题解析:(1)亚硫酸的酸性比硫酸弱,根据强制弱的复分解反应原理,Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,因此应选择浓硫酸和亚硫酸钠制取二氧化硫气体,不能选择亚硫酸钙,因为亚硫酸钙、硫酸钙都微溶于水;也不能选择浓盐酸,因为盐酸具有挥发性,产生的HCl、水蒸气对镁与二氧化硫的反应产物产生干扰;(2)上述装置缺少干燥装置,应在在A和B之间增加用浓硫酸干燥的装置;二氧化硫具有酸性氧化物的通性,容易与氢氧化钠溶液反应生成亚硫酸钠和水,从而吸收多余的二氧化硫、防止污染环境;(3)由于CO2(g)+4Na(g) 2Na2O(s)+C(s,金刚石),则CO2+2Mg
2Na2O(s)+C(s,金刚石),则CO2+2Mg 2MgO+C,由此类比或仿写,则2Mg+SO2
2MgO+C,由此类比或仿写,则2Mg+SO2 2MgO+S;装置B中固体产物可能是MgO和S或MgSO3和S或MgO和MgS,根据物质性质及已知信息可知,单质硫是难溶于水的黄色固体,也不溶于盐酸或稀硝酸;氧化镁难溶于水,可溶于盐酸或硝酸;亚硫酸镁微溶于水,易溶于盐酸或硝酸,但前者反应产生二氧化硫气体,二氧化硫气体可用品红溶液检验,后者没有二氧化硫产生,而是产生一氧化氮;硫化镁微溶于水,易溶于盐酸或硝酸,前者反应生成硫化氢气体,硫化氢通入硫酸铜溶液产生黑色沉淀,后者不产生硫化氢,而是产生单质硫和一氧化氮气体;根据上述性质可以确定检验试剂,以及预期现象和结论,从而设计合理的实验方案;(4)先根据c?V=n求稀盐酸中溶质的物质的量,再根据n?M=m求稀溶液中溶质的质量,由于稀释前后溶质质量保持不变,然后根据溶质质量除质量分数可求浓盐酸的质量,最后根据浓溶液质量除以密度求浓盐酸的体积,即浓盐酸体积计算表达式=
2MgO+S;装置B中固体产物可能是MgO和S或MgSO3和S或MgO和MgS,根据物质性质及已知信息可知,单质硫是难溶于水的黄色固体,也不溶于盐酸或稀硝酸;氧化镁难溶于水,可溶于盐酸或硝酸;亚硫酸镁微溶于水,易溶于盐酸或硝酸,但前者反应产生二氧化硫气体,二氧化硫气体可用品红溶液检验,后者没有二氧化硫产生,而是产生一氧化氮;硫化镁微溶于水,易溶于盐酸或硝酸,前者反应生成硫化氢气体,硫化氢通入硫酸铜溶液产生黑色沉淀,后者不产生硫化氢,而是产生单质硫和一氧化氮气体;根据上述性质可以确定检验试剂,以及预期现象和结论,从而设计合理的实验方案;(4)先根据c?V=n求稀盐酸中溶质的物质的量,再根据n?M=m求稀溶液中溶质的质量,由于稀释前后溶质质量保持不变,然后根据溶质质量除质量分数可求浓盐酸的质量,最后根据浓溶液质量除以密度求浓盐酸的体积,即浓盐酸体积计算表达式=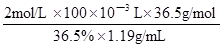 =16.8mL;根据量筒的使用方法,25mL规格量筒最接近16.8mL,因此应选择25mL规格。
=16.8mL;根据量筒的使用方法,25mL规格量筒最接近16.8mL,因此应选择25mL规格。
本题难度:困难