微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 1mol铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH的物质的量之比为( )
A.1:1
B.2:1
C.3:1
D.1:3
参考答案:足量的稀盐酸和氢氧化钠溶液反应,则Al完全反应,两个反应放出的气体在相同状况下体积相等时,
由2Al~2NaOH~6HCl~3H2可知,
反应中消耗的HCl和NaOH的物质的量之比为6mol:2mol=3:1,
故选C.
本题解析:
本题难度:一般
2、选择题 100 mL 2 mol·L-1的盐酸分别与0.5 mol Na、Mg、Al充分反应,在相同条件下产生H2的量(?)
A.一样
B.Na多
C.Mg多
D.Al多
参考答案:B
本题解析:Na、Mg、Al均过量,但常温下过量的Na还可与水反应。
本题难度:简单
3、选择题 用坩埚钳夹住一小块刚用酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释不正确的是
A.铝在空气中能很快形成氧化膜
B.金属铝活动性较弱,不能在空气中燃烧
C.氧化铝的熔点比铝高
D.氧化铝薄膜包住了熔化的铝
参考答案:B
本题解析:将铝箔用坩埚钳夹住放在酒精灯火焰上加热,铝和氧气反应生成了氧化铝,又因三氧化二铝的熔点高于铝的熔点,而三氧化二铝在铝的表面,所以加热铝箔的时候铝熔化了但是不会滴落.B错误。
本题难度:一般
4、实验题 (12分)工业上用铝土矿(主要成分为Al2O3,Fe2O3等)提取Al2O3做冶炼铝的原料,由熔盐电解法获得的粗铝中含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下图所示:
(已知:NaCl熔点为801℃;AlCl3在181℃升华)

(1)向滤液中通入过量CO2所发生反应的离子方程式为?。
(2)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为?。
(3)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去。气泡的主要成分除Cl2外还含有______。固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在________。
(4)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为_____________。
(5)钢材镀铝后,抗腐蚀性能会大大增强,其原因是_____________。
参考答案:(12分)
(1) AlO2— +2H2O +CO2=Al(OH)3↓+HCO3—(2分)
(2)Fe2O3+2Al Al2O3+2Fe(2分)
Al2O3+2Fe(2分)
(3)HCl和AlCl3 (2分)? NaCl(2分)
(4)Al-3e-+4Cl-= AlCl4-(2分)
(5)表面形成的致密氧化铝膜能防止钢材腐蚀,或致密的氧化铝膜将环境中的电解质溶液与内层金属隔离?(2分)
本题解析:(1)滤液中含有AlO2— ,通入CO2,生成Al(OH)3沉淀,离子方程式为:AlO2— +2H2O +CO2=Al(OH)3↓+HCO3—
(2)铝在高温条件下,把Fe2O3还原为Fe,化学方程式为:Fe2O3+2Al Al2O3+2Fe
Al2O3+2Fe
(3)因为粗铝中含有氢气,所以与Cl2反应生成AlCl3和H2,AlCl3在181℃升华,所以气泡的主要成分除Cl2外还含有HCl和AlCl3;粗铝中含有Na,与Cl2反应生成NaCl,NaCl熔点为801℃,所以浮渣中肯定存在NaCl。
(4)Al失电子生成AlCl4-,电极方程式为:Al-3e-+4Cl-= AlCl4-
(5)Al在空气中与O2反应生成Al2O3,表面形成的致密氧化铝膜,能防止钢材腐蚀。
本题难度:一般
5、选择题 将等体积、等pH的NaOH溶液和NH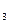 ·H
·H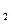 O溶液,分别全部加入到甲、乙烧杯中。
O溶液,分别全部加入到甲、乙烧杯中。
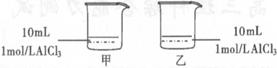
下列说法正确的是(? )
A.甲中沉淀一定比乙多
B.乙中沉淀一定比甲多
C.甲中沉淀可能比乙多
D.甲和乙中沉淀可能一样多
参考答案:D
本题解析:略
本题难度:一般