微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如图
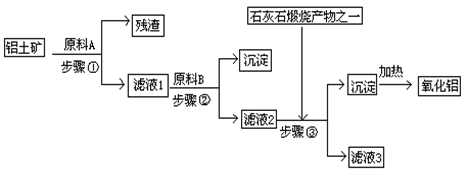
⑴原料A的名称是_____________,步骤①反应的离子方程式是_________________。
⑵滤液1中要加入稍过量原料B,原料B的化学式是________________,步骤②反应的离子方程式是:__________________________________________。
⑶步骤③的化学方程式是:_____________________________________________。
⑷如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响____________________________________________________________。
参考答案:⑴盐酸(硫酸、硝酸)? Al2O3+6H+=2Al3++3H2O? Fe2O3+6H+=2Fe3++3H2O
⑵NaOH? H++OH-=H2O? Fe3++3OH-=Fe(OH)3 ↓? Al3++4OH-=AlO2-+2H2O
⑶NaOH+CO2=NaHCO3、NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
⑷若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质
本题解析:(1)石灰石煅烧的生成物是CO2,这说明步骤③中加入的是CO2,所以滤液②中含有偏铝酸钠。因此原料B是氢氧化钠,则滤液①中氯化铝,所以试剂①是盐酸(或稀硫酸、硝酸等)。二氧化硅与酸是不反应的,所以步骤①中的离子方程式是
Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O。
(2)滤液①中含有过量的盐酸,以及生成的氯化铝和氯化铁,所以加入过量的氢氧化钠时反应的离子方程式是H++OH-=H2O、Fe3++3OH-=Fe(OH)3 ↓、Al3++4OH-=AlO2-+2H2O。
(3)滤液③中含有过量的氢氧化钠以及生成的偏铝酸钠,所以通入过量的CO2时的化学方程式是NaOH+CO2=NaHCO3、NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3。
(4)若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后在生成的氢氧化铝中混有硅酸沉淀,硅酸分解生成二氧化硅,使加热制得的Al2O3混有SiO2杂质,所以不能省去步骤①。
本题难度:一般
2、填空题 有一无色透明溶液,可能含Al3+、Fe3+、Mg2+、Na+、CO32-、Cl-、NO3-等离子中的若干种。现做如下实验:
一、取少量该溶液,滴入用硝酸酸化的AgNO 3溶液,有白色沉淀生成。
二、另取部分溶液,加入氢氧化钠,有白色沉淀产生,加入氢氧化钠的量与生成白色沉淀的量可用下图表示。
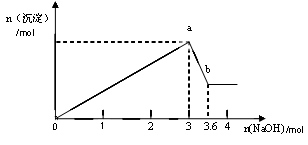
试推断:
(1)该溶液中一定存在__________?____,一定不存在________________。
(2)由图可知白色沉淀共有__________种,分别是__________________(填化学式),其物质的量比为?。
(3) 写出图中a b变化过程的离子方程式??。
b变化过程的离子方程式??。
参考答案:(1)Al3+、Mg2+、Cl-?; Fe3+、CO32-
(2)2;? Al(OH)3、Mg(OH)2?;?1:1
(3)Al(OH)3+ OH- AlO2-+ 2H2O
AlO2-+ 2H2O
本题解析:由于溶液是无色透明的,所以,首先排除Fe3+的存在,因为Fe3+的溶液呈棕黄色。取少量该溶液,滴入用硝酸酸化的AgNO 3溶液,有白色沉淀生成,说明该溶液中一定存在Cl-,因为只有AgCl白色溶液是不溶于稀HNO3的。另取部分溶液,加入氢氧化钠溶液,现象为先有沉淀,后沉淀消失,说明原溶液中一定存在Al3+、Mg2+,同时排除了CO32-的存在,因为Al3+、Mg2+与CO32--会反应,不能大量共存。而Na+与NO3-存不存在都对整个现象无影响。当沉淀的量达到最高时,再加入氢氧化钠溶液,沉淀部分消失,其原因是生成的氢氧化铝沉淀是两性氢氧化物,能与氢氧化钠溶液继续反应生成偏铝酸钠和水,而氢氧化镁沉淀则不能与氢氧化钠溶液反应。
本题难度:一般
3、选择题 铝热剂中铝的作用是(? )
A.催化剂
B.氧化剂
C.还原剂
D.还原产物
参考答案:C
本题解析:Al-----Al2O3?化合价升高被氧化,做还原剂。
本题难度:简单
4、选择题 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
[? ]
A.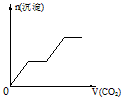
B.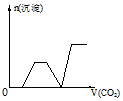
C.
D.
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列各组物质与其用途的关系不正确的是
[? ]
A.过氧化钠:供氧剂
B.烧碱:治疗胃酸过多的一种药剂
C.氧化铝:耐火坩埚
D.明矾:净水剂
参考答案:B
本题解析:
本题难度:简单