微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用98%,密度为1.84g·cm-3的浓H2SO4配制1mol/L的稀硫酸100mL,现给出可能用到的仪器:①100mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤100mL容量瓶;⑥胶头滴管;⑦玻璃棒。按使用仪器先后顺序排列正确的是(?)
A.④③⑦⑤⑥
B.②⑤⑦⑥
C.①③⑤⑦④⑥
D.②③⑦⑤⑥
参考答案:D
本题解析:配制一定物质的量浓度溶液的过程为:计算、量取、溶解、转移、洗涤、定容、摇匀和装瓶贴签,因此用到的仪器顺序是10 mL量筒,50mL烧杯,玻璃棒,100mL容量瓶和胶头滴管。答案选D。
点评:本题基础简单,考查学生实验的基本能力。
本题难度:一般
2、选择题 设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
B.在熔融状态下,1 mol NaHSO4完全电离出的阳离子数为2NA
C.78 g Na2O2固体与H2O完全反应转移的电子数为NA
D.5.6 g铁粉在2.24 L(标准状况)氯气中充分燃烧,失去的电子数为0.3NA
参考答案:C
本题解析:温度和压强未知,分子数为NA的(28 g)CO和C2H4混合气体的体积不能确定,A项错误;在熔融状态下,NaHSO4 Na++HS
Na++HS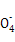 ,故1 mol NaHSO4完全电离产生的阳离子数为NA,B项错误;分析2Na2O2+2H2O
,故1 mol NaHSO4完全电离产生的阳离子数为NA,B项错误;分析2Na2O2+2H2O 4NaOH+O2↑可知,1 mol Na2O2完全反应转移的电子数为NA,C项正确;5.6 g Fe、2.24 L(标准状况下)Cl2的物质的量均为0.1 mol。据2Fe+3Cl2
4NaOH+O2↑可知,1 mol Na2O2完全反应转移的电子数为NA,C项正确;5.6 g Fe、2.24 L(标准状况下)Cl2的物质的量均为0.1 mol。据2Fe+3Cl2 2FeCl3可知转移的电子数为0.2NA,D项错误。
2FeCl3可知转移的电子数为0.2NA,D项错误。
本题难度:一般
3、选择题 下列关于0.05mol /L的K2SO4溶液的说法中,正确的是
A.1L溶液中含有K+、SO42-总数为0.03NA
B.1L溶液中含有K+数目是0.1NA
C.1 L溶液中K+的浓度是0.20 mol / L
D.2 L溶液中含有SO42-的浓度是0.3mol / L
参考答案:B
本题解析:在0.05mol /L的K2SO4溶液中K+的浓度是0.10 mol / L、SO42-的浓度是0.05mol / L,而与溶液体积无关,排除CD选项;在1L的0.05mol /L的K2SO4溶液中,K+数目为0.05×2×1×NA=0.1NA,SO42-个数为0.05NA,两者总数为0.15NA,故答案为B
本题难度:一般
4、选择题 下列溶液中Al3+的浓度与50 mL 1 mol·L-1的Al2(SO4)3溶液中的Al3+浓度相等的是(? )
A.100 mL 1 mol·L-1 AlCl3
B.75 mL 2 mol·L-1 Al(NO3)3
C.50 mL 3 mol·L-1 AlCl3
D.25 mL 2 mol·L-1 Al2(SO4)3
参考答案:B
本题解析:离子浓度大小决定于溶液中溶质浓度,与体积大小无关。1 mol·L-1 Al2(SO4)3,c(Al3+)="2" mol·L-1,而A、B、C、D选项中Al3+浓度分别为1 mol·L-1、2 mol·L-1、3 mol·L-1、4 mol·L-1。
本题难度:简单
5、填空题 要准确掌握化学用语及常用计量方法。按要求回答下列问题:
(1)NA表示阿伏加德罗常数。28g乙烯和环丁烷(C4H8)的混合气体中含有____NA个碳原子;分子总数为NA个的NO2和CO2混合气体含______ NA个氧原子数;1mol37Cl中,中子数比质子数多_______ NA个;1L 1mol/LFe2(SO4)3溶液中含_____NA个SO42-离子。
(2)图中A、B分别是某微粒的结构示意图,回答下列问题:

①若A表示某元素的原子,则y=?。
②若B表示某稀有气体元素的原子,则该元素的单质的化学式为?,若B是阴离子的结构示意图,则x的取值范围是________________。
(3)RxO42-中R的化合价为___________(用含x 的式子表示),当0.3 mol RxO42-完全反应,生成RO2时,转移0.6 mol电子,则x=__________。
(4)将7.8 g镁铝合金与100mL 稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐46.2 g,则原硫酸的物质的量浓度为______________。
参考答案:(1)2,2,3,3(每空均为1分)
(2)①6(1分);②Ar(1分,写名称不得分),14≤x≤17
(3)+6/x; 1或2(答对一个得1分)?(4)4mol/L(无单位扣1分)
本题解析:(1)乙烯和环丁烷(C4H8)的最简式都是CH2,所以28g乙烯和环丁烷(C4H8)的混合气体中碳原子的物质的量=28g÷14g/mol=2mol。因此若NA表示阿伏加德罗常数,则28g乙烯和环丁烷(C4H8)的混合气体中含有2NA个碳原子;分子总数为NA个的NO2和CO2混合气体的物质的量是1mol,由于NO2和CO2均是含有2个氧原子的,所以分子总数为NA个的NO2和CO2混合气体含2NA个氧原子数;在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,所以1mol37Cl中,中子数比质子数多(37-17-17)×NA=3 NA个;1L 1mol/LFe2(SO4)3溶液中溶质硫酸铁的物质的量=1L×1mol/L=1mol,在溶液中硫酸铁的电离方程式为Fe2(SO4)3=2Fe3++3SO42-,所以溶液中含3NA个SO42-离子。
(2)①若A表示某元素的原子,则核外电子数=质子数,即2+y=8,所以y=6。
②若B表示某稀有气体元素的原子,则该元素的质子数=2+8+8=18,因此则该元素是Ar,其的单质的化学式为Ar。若B是阴离子的结构示意图,则B是第三周期的非金属,因此x的取值范围是14≤x≤17。
(3)氧元素的化合价是-2价,则 RxO42-中R的化合价为+(8-2)÷x=+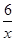 ?(用含x 的式子表示)。当0.3 mol RxO42-完全反应,生成RO2时,转移0.6 mol电子。由于RO2中R元素的化合价是+4价,如果反应中R元素的化合价从+
?(用含x 的式子表示)。当0.3 mol RxO42-完全反应,生成RO2时,转移0.6 mol电子。由于RO2中R元素的化合价是+4价,如果反应中R元素的化合价从+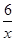 降低到+4价,则0.3mol×(
降低到+4价,则0.3mol×(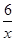 -4)×x=0.6mol,解得x=1。如果反应中R元素的化合价从+
-4)×x=0.6mol,解得x=1。如果反应中R元素的化合价从+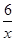 升高到+4价,则0.3mol×(4-
升高到+4价,则0.3mol×(4-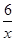 )×x=0.6mol,解得x=2。
)×x=0.6mol,解得x=2。
(4) 将7.8 g镁铝合金与100mL 稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐46.2 g,则根据原子守恒可知,硫酸盐中SO42-的质量=46.2g-7.8g=38.4g,物质的量=38.4g÷96g/mol=0.4mol,因此原硫酸的物质的量也是0.4mol,其浓度=0.4mol÷0.1L=4.0mol/L。
本题难度:一般