微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)某学生为了测定由两种元素形成的气态化合物X的组成,进行了如图所示的实验,将装置内空气排尽后,把气体X由注射器A缓慢送入装有CuO的B装置,使之完全反应(气态化合物X与CuO均无剩余),得到如下结果:
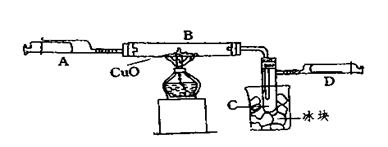
①实验前B管及药品的质量为21.32克,实验后为21.16克
②C管中收集到的物质电解后可得到H2和O2,在D中收集到的是N2。
③X中两元素的质量比是14:3。问:
(1)C中收集到的液体,物质的量是 mol;
(2)在实验中看到的现象是 。
(3)B中反应的化学方程式是 。
参考答案:(1)0.01mol; (2)黑色固体逐渐变为红色;C管中有无色液体出现;D的内管向外推动。
(3)2NH3+3CuO 3Cu十N2↑+3H2O
3Cu十N2↑+3H2O
本题解析:(1)“D中收集到的是N2”,“C管中收集到的物质电解后可得到H2和O2”,根据这两个信息知道X中含有N、H两中元素,C是H2O,又有“X中两元素的质量比是14:3” 则可得氮、氧两种元素的原子个数比为1:3.所以X化学式为NH3; “由实验前B管及药品的质量为21.32g,实验后为21.16g”,可知B管质量减少了0.16g;减少的是O元素的质量,n(O)= 0.16g÷16g/mol="0.01mol" ,则收集到的水的物质的量为0.01mol;(2)根据以上分析知道氧化铜与氨气反应生成铜和水和氮气.所以现象为黑色固体逐渐变为红色,C管中生成水,冷却后变为无色液体,产生氮气,压强增大,注射器的内管向外推动;(3)根据以上分析,反应物为NH3和CuO,生成物为Cu、N2和H2O,则化学方程为:2NH3+3CuO 3Cu十N2↑+3H2O
3Cu十N2↑+3H2O
考点:物质组成的推测、实验现象的描述和物质的量的有关计算。。
本题难度:一般
2、填空题 在标准状况下,①4g氢气②33.6L甲烷③6.02×1023个水分子,含分子数最多的是(填序号,下同)______,含原子数最多的是______,质量最大的是______,体积最小的是______.
参考答案:氢气的物质的量为2mol,氢气分子数为2NA,氢原子数为4NA,标准状况下的体积为44.8L;
甲烷的物质的量为1.5mol,质量为24g,分子数为1.5NA,原子数为1.5NA×5=7.5NA;
水的物质的量为1mol,质量为18g,分子数为1NA,原子数为1NA×3=3NA,水常温下是非气体,其体积约为18mL.
综上分析,可知:含分子数最多的是①,含原子数最多的是②,质量最大的是②,体积最小的是③.
故答案为:①;②;②;③.
本题解析:
本题难度:一般
3、选择题 设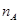 ?为阿伏加德罗常数的数值,下列说法正确的是
?为阿伏加德罗常数的数值,下列说法正确的是
A.16g 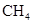 中含有4
中含有4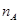 个C-H键
个C-H键
B.1mol·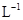
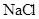 溶液含有
溶液含有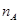 个
个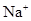
C.1mol Cu和足量稀硝酸反应产生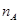 个NO分子
个NO分子
D.常温常压下,22.4L 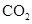 中含有
中含有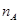 个
个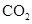 分子
分子
参考答案:A
本题解析:考查阿伏加德罗常数的有关计算。每个CH4中含有4个C-H键,故16gCH4(1mol)中含有4nA个C-H键,A正确;B项没有告诉溶液的体积,无法知道NaCl的物质的量,故B不正确;根据化学反应关系3molCu~2molNO,故C不正确;常温常压下22.4L CO2不是1mol,故D不正确,答案选A。
本题难度:简单
4、实验题 (14分)某同学帮助水质检测站配制800mL 1 mol·L-1NaOH溶液以备使用。
(1)该同学应选择的玻璃仪器除了烧杯、量筒、玻璃棒、胶头滴管外,还有___________。
(2)其操作步骤如下图所示,则如图操作应在下图中的 (填选项字母)之间。
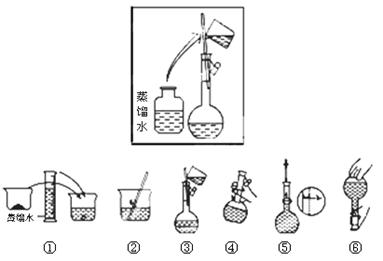
A.②与③ B.①与② C.④与⑤
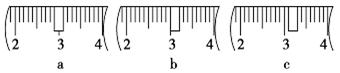
(3)该同学应用托盘天平称取NaOH固体 g,用质量为33.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在下图中选出能正确表示游码位置的选项 (填选项字母)。
(4)下列操作对所配溶液的浓度大小有何影响 (填“偏大”、“偏小”或“无影响”)。
①定容时,俯视读数,浓度会 ;
②转移溶液过程中,少量液体溅出来,浓度会 ;
③容量瓶未干燥,浓度会 ;
④定容摇匀后发现溶液凹面低于刻度线,浓度会 。
(5)配制溶液的实际操作过程中,动作要快,否则由于 ,会使配制的NaOH溶液的浓度比1 mol·L-1 (填“大”或“小”)。
参考答案:(1)1000mL容量瓶;(2)C; (3)40.0; c;(4)①偏大 ②偏小 ③无影响 ④无影响
(5)NaOH易潮解、易吸收空气中的CO2而变质(答出一点即可); 小 ;
本题解析:(1)一定物质的量浓度溶液的配制一定要用到容量瓶。(2)图所示的操作是加入蒸馏水,在移液之后,定容之前,选C(3)容量瓶用的是1000mL容量瓶,所以计算时溶液的体积有1000m,m=c×v×m=1mol/L×1L×40g/mol=40g,加上33.1 g的烧杯总质量为73.31g, 游码位置要移到3.1g的位置,故选C。(4)①定容时,俯视读数造成溶液体积偏大,浓度就偏大;②转移溶液过程中,少量液体溅出来造成溶质有损失,浓度偏小。③定容是要加水,所以没有影响。④摇匀后发现溶液凹面低于刻度线那是分子间所用力造成的,对浓度无影响。
考点:一定物质的量浓度溶液的配制和误差分析。
本题难度:一般
5、选择题 下列溶液中物质的量浓度为1mol/L的是 ( )
A.将40gNaOH固体溶解于1L水中
B.将22.4L氯化氢气体溶于水配成1L溶液
C.将1L10 mol/L的浓盐酸与9L水混合
D.10gNaOH固体溶解在水中配成250mL溶液