微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是
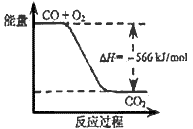
[? ]
A.CO的燃烧热为283 kJ
B.上图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×1023
参考答案:C
本题解析:
本题难度:一般
2、填空题 (12分)
(1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH—)为??mol·L-1。(2)等体积的下列溶液中,阳离子的总物质的量最大的是?。(填序号)。
① 0.2 mol·L-1的CuSO4溶液?② 0.1 mol·L-1的Na2CO3
③ 0.2 mol·L-1的KCl?④ 0.1 mol·L-1的Na2SO4
(3)浓度为0.100 mol·L-1的下列各物质的溶液中,c(NH4+)由大到小的顺?。(填序号)。
①NH4Cl?②NH4HSO4?③NH3·H2O?④CH3COONH4?
(4) 水的电离平衡如图所示:

①若A点表示25℃时水的电离平衡状态,当温度上升到100℃时,水的电离平衡状态到达B点。则此时水的离子积从??增加到??。
②100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH值pH1与强碱的pH值pH2之间应满足的关系是?。
参考答案:(1)10-2?(2)①?
(3)②?>①?>④?>③?(4)① 10—14?10—12?
② pH1+pH2=13
本题解析:(1)NaCN水解显碱性,促进水的电离,所以,由水电离的c(OH—)为0.01 mol·L-1。
(2)①③的浓度大,阳离子的数量就多。因为1个铜离子水解生成2个阳离子,方程式为Cu2++2H2O Cu(OH)2+2H+。即①中阳离子的总物质的量最大。
Cu(OH)2+2H+。即①中阳离子的总物质的量最大。
(3) NH4+水解显酸性,NH4HSO4能电离出氢离子抑制其水解,而CH3COONH4中醋酸根水解显碱性,促进NH4+水解,所以c(NH4+)由大到小的顺序为②?>①?>④?>③。
(4)温度升高促进水的电离,由图像可知当温度升高到100℃时,水的离子积将由10—14升高到10—12。溶液显中性,则10×10-pH1=1×10 pH2-12,解得pH1+pH2=13。
本题难度:一般
3、计算题 在25 ℃时,有pH为x的盐酸和pH为y的NAOH溶液,取Vx L该盐酸同该NAOH溶液中和,需Vy L NAOH,求:
(1)若x+y=14时,则Vx/Vy=_______________(填数值)。
(2)若x+y=13时,则Vx/Vy=_______________(填数值)。
(3)若x+y>14时,则Vx/Vy=_______________(填表达式),且VxVy____________(填“>”“=”或“<”)。
参考答案:(1)1?(2)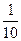 (3)10x+y-14?>
(3)10x+y-14?>
本题解析:因为pH="x?" c(H+)=10-x mol·L-1
pH="y?" NaOH中pOH="14-y?" c(OH-)=10-(14-y)=10y-14
H+? +? OH-====H2O
10-x×Vx? 10y-14×Vy
所以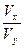 =
=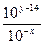 =10x+y-14
=10x+y-14
本题难度:简单
4、选择题 已知:①2C(s)+O2(g)===2CO(g) ΔH1 ②2CO(g)+O2(g)===2CO2(g) ΔH2
下列说法中正确的是
A.碳的燃烧热ΔH为0.5ΔH1kJ·mol-1
B.②能表示CO燃烧热的热化学方程式
C.碳的燃烧热ΔH=0.5(ΔH1+ΔH2)
D.碳的燃烧热小于CO的燃烧热
参考答案:C
本题解析:两式相加得:C(s)+O2(g)=== CO2(g) (ΔH1+ΔH2)/2,且燃烧热是指 1 mol 可燃物生成稳定的氧化物时所对应的热量,故答案为C。
本题难度:一般
5、选择题 对pH=3的醋酸溶液和pH=3的HCl溶液等体积混和后,溶液的PH值?
A.PH<3
B.PH>3
C.PH="3"
D.无法确定
参考答案:C
本题解析:对醋酸来说:CH3COOH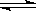 CH3COO- +H+
CH3COO- +H+
化学平衡常数K="[" CH3COO-][ H+]/[CH3COOH]
加入PH=3的盐酸,体积增加一倍,则 [ CH3COO-]和[CH3COOH]的浓度减少一倍,而K是定值不变,则K="[" CH3COO-][ H+]/[CH3COOH]中[ H+]不变,混合后溶液的PH=3
本题难度:一般