微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列事实不能用电化学理论解释的是
[? ]
A.轮船水线以下的船壳上装一定数量的锌块
B.铝片不用特殊方法保存
C.锌粒与稀硫酸反应,滴入少量CuSO4溶液后速率加快
D.镀锌铁比镀锡铁耐用
2、填空题 (14分)据图回答下列问题:
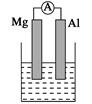
Ⅰ、(1)若烧杯中溶液为稀硫酸,则观察到的现象是 ___________________
负极反应式为:______________________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________(填Mg或Al),总反应化学方程式为____________________________________。
Ⅱ、由Al、Cu、浓硝酸组成原电池,其正极的电极反应式为
Ⅲ、中国科学院长春应用化学研究所在甲醇燃料电池技 术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。

①该电池工作时,b口通入的物质为_______,
c口通入的物质为______。
②该电池负极的电极反应式为:_______
③工作一段时间后,当12.8 g甲醇完全反应生成CO2时,______________NA个电子转移。
3、选择题 用锌片、铜片和硝酸银组成的原电池,正极上发生的电极反应是
A.2H++2e-=H2↑
B.Zn-2e-=Zn2+
C.2H2O+O2+4e-=4OH-
D.Ag++e-=Ag
4、填空题 Ⅰ.氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
3SiO2+6C+2N2 Si3N4+6CO;DH <0。
Si3N4+6CO;DH <0。
(1)在容积固定的密闭容器中,分别在三种不同的实验条件下进行上述制备反应,测得N2的物质的量浓度随时间的变化如图所示,
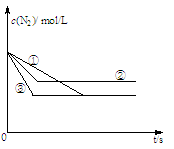
②和③分别仅改变一种反应条件。所改变的条件分别是:② ;③ 。
(2)1 000℃时,在2 L密闭容器中进行上述反应,若起始时N2浓度为4.0 mol/L,经1小时反应达到平衡状态,此时容器内气体总浓度为10.0 mol/L,则以CO表示的反应速率为 。
Ⅱ.图为Mg—NaClO燃料电池结构示意图。
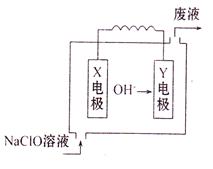
已知电解质溶液为NaOH溶液,且两电极中有一电极为石墨电极。
(1)Y电极材料为 。
(2)X电极发生的电极反应式为 。
(3)若该电池开始时加入1L 0.2mol/L的NaOH溶液,然后从下口充入1L 0.1mol/L的NaClO溶液(忽略整个过程的体积变化),当NaClO完全放电时溶液的pH= 。
5、简答题 (1)将反应2FeCl3+Fe=3FeCl2设计成原电池。____________________
(2)判断正负极并写出电极反应。________________________