微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 (1)相同质量的SO2、SO3的物质的量之比为____________;氧原子的个数之比为_ _______。
(2)19 g某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则ACl2的摩尔质量是________;A的相对原子质量是____________;ACl2的化学式是__________。
参考答案:(1)5∶4 5∶6 (2)95 g·mol-1 24 MgCl2
本题解析:(1)根据 n=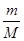 可知,相同质量的SO2、SO3的物质的量之比=
可知,相同质量的SO2、SO3的物质的量之比=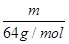 :
: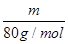 =5∶4;氧原子的个数之比=5×2∶4×3=5∶6。
=5∶4;氧原子的个数之比=5×2∶4×3=5∶6。
(2)19 g某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则ACl2的物质的量=0.4mol÷2=0.2mol,因此根据n=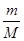 可知,该化合物的摩尔质量M=19.2g÷0.2mol=95 g/mol;氯元素的相对原子质量35.5,所以A的相对原子质量=95-35.5×2=24,因此A是Mg,则该化合物的化学式是MgCl2。
可知,该化合物的摩尔质量M=19.2g÷0.2mol=95 g/mol;氯元素的相对原子质量35.5,所以A的相对原子质量=95-35.5×2=24,因此A是Mg,则该化合物的化学式是MgCl2。
考点:考查物质的量的有关计算、化学式确定
本题难度:一般
2、选择题 2a LFe2(SO4)3和(NH4)2SO4的混合液分成两等份,向其中一份加入b mol的BaCl2溶液,恰好使溶液中的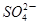 完全沉淀;向另一等份加入足量NaOH固体并加热可得到c mol NH3,则原溶液中Fe3+的物质的量浓度为(?)mol·L-1
完全沉淀;向另一等份加入足量NaOH固体并加热可得到c mol NH3,则原溶液中Fe3+的物质的量浓度为(?)mol·L-1
A.
B.
C.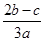
D.
参考答案:C
本题解析:由题意可知每份含有n(SO42-)="b" mol ;n(NH4+)=cmol,则含有(NH4)2SO4的物质的量为n((NH4)2SO4)="c/2mol." 含有Fe2(SO4)3的物质的量为n(Fe2(SO4)3)="{" ( b- c/2)÷3} mol.所以原溶液中Fe3+的物质的量浓度为{ ( b- c/2)÷3} ×2mol/aL="(2b-c)/3" mol/L.选项为:C。
本题难度:一般
3、填空题 (1)0.5mol?H2SO4?的质量是______?g,含______个分子,含______mol氧原子,该硫酸所含氢元素的质量与______mol?HCl中所含氢元素的质量相同.
(2)在相同条件下,含有相同分子个数的SO2和SO3,其质量比为______,物质的量比为______,其中所含氧原子个数比为______.
参考答案:(1)m(H2SO4)=0.5mol×98g/mol=49g,
N(H2SO4)=n?NA=0.5mol×6.02×1023/mol=3.01×1023,
n(O)=4×0.5mol=2mol,
n(H)=2×0.5mol=1mol,
该硫酸所含氢元素的质量与1molHCl中所含氢元素的质量相同,
故答案为:49;3.01×1023;2;1;
(2)设SO2和SO3的分子个数都为N个,
则由n=mM=NNA可知:物质的量相同.质量比等于相对分子质量之比,为64:80=4:5,
其中所含氧原子个数比为2:3,
故答案为:4:5;1:1;2:3.
本题解析:
本题难度:一般
4、选择题 某气体物质质量为6.4 g,含有6.02×1022个分子,则该气体的相对分子质量为( )
A.64
B.32
C.96
D.16