微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (6分)取50.0mL的碳酸钠和硫酸钠的混合溶液,加入过量氯化钡溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出。试计算:
(1)原混合液中碳酸钠和硫酸钠的物质的量浓度。
(2)产生气体的质量
参考答案:(1)c(Na2CO3)=1.0mol/L c(Na2SO4)="0.4" mol/L,
(2)2.2g
本题解析:试题分析:(1)根据题意可知4.66g的沉淀是硫酸钡,则硫酸钡的物质的量是4.66g/233g/mol=0.02mol,所以硫酸钠的物质的量浓度=0.02mol/0.05L=0.4mol/L,共生成沉淀14.51g,则碳酸钡沉淀的质量是14.51-4.66=9.85g,所以碳酸钡的物质的量是9.85g/197g/mol=0.05mol,则碳酸钠的物质的量浓度=0.05mol/0.05L=1.0mol/L;
(2)根据(1)可知碳酸钡的物质的量是0.05mol,根据BaCO3~CO2,可得二氧化碳的物质的量也是0.05mol,所以生成气体的质量是0.05mol×44g/mol=2.2g
本题难度:一般
2、选择题 把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含amol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
[? ]
A.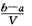 mol·L-1
mol·L-1
B.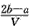 mol·L-1
mol·L-1
C.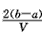 mol·L-1
mol·L-1
D.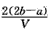 mol·L-1
mol·L-1
参考答案:D
本题解析:
本题难度:一般
3、选择题 设阿伏加德罗常数为6.02×1023 mol-1 。关于1mol H2O的叙述正确的是?
A.含有1mol H2
B.含有6.02×1023个水分子
C.质量为18 g/mol
D.在标准状况下的体积为22.4 L
参考答案:B
本题解析:1mol水中含有1mol水分子,即NA个;不含氢气分子,故A错;质量为18g,C错;标况下,水为液体。
本题难度:一般
4、填空题 明矾石的主要成分为K2SO4·Al2(SO4)3·2Al2O3·6H2O,此外还含有少量Fe2O3杂质。某校研究小组利用明矾石制备氢氧化铝的流程如下:
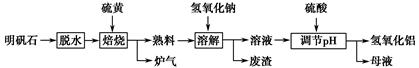
(1)“焙烧”过程中反应的化学方程式为 Al2(SO4)3+
Al2(SO4)3+ S
S
 Al2O3+
Al2O3+ ______↑。
______↑。
(2)分离溶液和废渣的操作是________,“溶解”时反应的离子方程式为_________________________________________________________________。
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是________。
(4)“母液”中可回收的物质是________。
(5)若“焙烧”过程中恰好消耗48 g硫黄,则理论上最终可得到________ g氢氧化铝。
参考答案:(1)2 3 2 9 SO2
(2)过滤 Al2O3+2OH-=2AlO3-+H2O
(3)取最后一次洗涤的滤液于试管中,滴加BaCl2溶液,若无白色沉淀生成,则证明已洗涤干净
(4)K2SO4、Na2SO4
(5)468
本题解析:(1)分析已知的反应物和生成物可知,只有硫元素化合价发生变化,故最终只可能生成SO2。(2)结合流程可知,分离溶液和废渣可用过滤操作;溶解时,Al2O3与碱反应。(3)Al(OH)3沉淀表面吸附有SO42-,故可取最后一次洗涤的滤液于试管中,滴加BaCl2溶液,若无白色沉淀生成则证明已洗涤干净。(4)“母液”中可回收的物质是易溶的K2SO4和Na2SO4。(5)根据反应的化学方程式可知,2Al2(SO4)3~3S,n(S)=1.5 mol,n[Al2(SO4)3]=1 mol,n(Al2O3)=1 mol,明矾石中n(Al2O3)=2 mol,依据铝元素守恒可知,n(Al)=n[Al(OH)3]=6 mol,则氢氧化铝质量为468 g。
本题难度:一般
5、选择题 设NA表示阿伏加德罗常数的值。下列说法正确的是(?)
A.标准状况下,0.1 mol Cl2溶于足量水,转移的电子数目为0.1NA
B.0.1 mol Fe 与足量的稀HNO3反应,转移0.2N A个电子
C.1 L 0.1 mol·L-1 Na2CO3溶液含有0.1NA 个CO3 2-
D.电解熔融NaCl得到7.1g Cl2,理论上需要转移0.2NA个电子
参考答案:D
本题解析:考查阿伏加德罗常数的有关计算。氯气溶于水的反应是可逆反应,转化率达不到100%,选项A不正确;硝酸过量,铁失去3个电子,选项B不正确;碳酸钠水解,所以选项C中CO32-的物质的量小于0.1mol,所以正确的答案选D。
本题难度:一般