微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (10分)(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为 (阿伏伽德罗常数用NA表示),放出的热量为 kJ。
(2)已知:C3H8(g ) ==== CH4(g)+HC≡CH(g)+H2(g) △H1=156.6kJ·mol-1
CH3CH=CH2(g) ==== CH4(g)+HC≡CH(g) △H2=32.4kJ·mol-1
则相同条件下,反应C3H8(g)====CH3CH=CH2 (g)+H2(g)的△H= kJ·mol-1。
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如右表:已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式 。
物 质
| 燃烧热(kJ·mol-1)
|
H2(g)
| -285.8
|
CO(g)
| -283.0
|
CH4(g)
| -890.3
|
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。请写出该电池的正极反应式 。
参考答案:(10分) (1) 1、6NA 173、4 (2) +124、2
(3)CH4(g) + H2O(g) ="=" CO(g) + 3H2(g) ?H= --1420、7 kJ/mol
(4) N2 + 6e + 8H+ ="=" 2NH4+
本题解析:(1)根据盖斯定律可知,①+②即得到CH4(g)+2NO2(g)=N2(g)+CO2(g )+2H2O(g) ΔH=-867 kJ·mol-1。标准状况下4.48 L CH4的物质的量为0.2 mol,失去0.2mol×8=1.6mol电子,放出的热量为0.2 mol×867 kJ·mol-1=173.4 kJ。
(2)同样根据盖斯定律可知,①-②即得到C3H8(g)====CH3CH=CH2 (g)+H2(g),所以该反应的△H=+156.6kJ·mol-1-32.4kJ·mol-1=+124.2kJ/mol。
(3)根据物质的燃烧热可知,①H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1、②CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1、③CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1、④ H2O(g)=H2O(l) △H=-44.0 kJ/mol。所以根据盖斯定律可知,③+④-①×3-②即得到CH4(g) + H2O(g) ="=" CO(g) + 3H2(g) ?H= --1420、7 kJ/mol。
(4)原电池中正极得到电子,所以氮气在正极得到电子。又因为溶液显酸性,所以正极电极反应式是N2 + 6e + 8H+ ="=" 2NH4+。
考点:考查反应热的计算、热化学方程式的书写以及电极反应式的书写等
点评:书写热化学方程式以及反应热的计算中,盖斯定律有着广泛的应用,需要熟练掌握并结合有关数学知识灵活运用。
本题难度:困难
2、填空题 按要求完成下列问题:
(1)在25℃、101kPa下,1g甲醇(液体,分子式为CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为____________________;将该反应设计成碱性燃料电池,写出该电池的负极电极反应方程式 。
(2)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-247.4 kJ·mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(3)已知白磷、红磷燃烧的热化学方程式分别为
P4(s,白磷)+ 5O2=P4O10(s);ΔH=
参考答案:
本题解析:
本题难度:困难
3、填空题 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
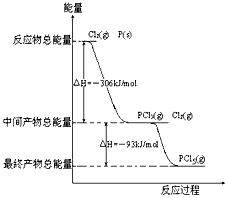
根据上图回答下列问题:
(1)PCl5分解成PCl3和Cl2的热化学方程式_________________________________
(2)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______
△H3(填“大于”、“小于”或“等于”)
参考答案:(1)PCl5(g)==PCl3(g)+Cl2(g);△H=+93kJ·mol-1
(2)-399kJ·mol-1;等于
本题解析:
本题难度:一般
4、选择题 已知:CH3CH2CH2CH3(g)+6.5 O2(g)===4CO2(g)+5H2O(l);ΔH=-2 878 kJ/mol (CH3)2CHCH3(g)+6.5
O2(g)===4CO2(g)+5H2O(l);ΔH=-2 869 kJ/mol 下列说法正确的是
[? ]
A.正丁烷分子储存的能量大于异丁烷分子
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
参考答案:A
本题解析:
本题难度:一般
5、简答题 已知CH4、H2、和CO的燃烧热(△H)分别为-890.3kJ?mol-1、-285.8kJ?mol-1和-283.0kJ?mol-1.
(1)用铂电极电解稀硫酸溶液,当阳极产生2.24L(标准状况)气体时需消耗的能量是(假设能量的利用率为80%)______.
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO(另一产物为H2),写出该反应的热化学方程式______;
(3)甲烷燃料电池是利用燃料甲烷跟氧气或空气反应,将化学能转化成电能的装置,电解质是强碱溶液.在甲烷燃料电池中:负极反应为______,放电时溶液中的阴离子向______极移动;随放电的进行,溶液的pH______(选填“增大”、“减小”或“不变”).若用该燃料电池电解氯化铜溶液,当消耗甲烷5.6L(标准状况)时,可生成铜的质量为(假设能量的利用率为100%)______.
参考答案:(1)用铂电极电解稀硫酸溶液,阳极生成O2,n(O2)=2.24L22.4L/mol=0.1mol,由氢气的燃烧热可知2H2O(l)=O2(g)+2H2(g)△H=+571.6kJ?mol?-1,则生成0.1mol需要O2吸收0.1mol×571.6kJ?mol?-1=57.16kJ,由于能量的利用率为80%,则实际应吸收51.76kJ80%=71.5kJ,故答案为:71.5kJ;
(2)根据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式:
①O2(g)+2H2(g)=2H2O(L)△H=-571.6kJ?mol?-1;
②CH4(g)+2O2(g)=CO2(g)+2H2O(L)△H=-890.3kJ?mol-1;
③2CO(g)+O2(g)=2CO2(g)△H=-566.03kJ?mol-1,
利用盖斯定律将②-①-③可得:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.3?kJ?mol?-1,
故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.3?kJ?mol?-1;
(3)在甲烷燃料电池中负极甲烷发生氧化反应生成CO32-和H2O,负极电极反应式为CH4+10OH--8e═CO32-+7H2O,放电时溶液中的阴离子向负极,总反应式为CH4+2O2+2OH-═CO32-+3H2O,OH-浓度降低,则pH减小,当消耗甲烷5.6L(标准状况)时,转移电子的物质的量为5.6L22.4L/mol×8=2mol,则生成铜1mol,质量为64g,
故答案为:CH4+10OH--8e═CO32-+7H2O;负;减小;64g.
本题解析:
本题难度:一般