微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知非金属单质A2、B2、C2之间能发生如下反应:A2+2B-=2A-+B2, B2+2C-=2B-+C2.以下说法正确的是?(?)
A.氧化性:A2>B2>C2
B.还原性:A->B->C-
C.单质活动性:C2>B2>A2
D.反应:A2+2C-=2A-+C2不能发生
参考答案:A
本题解析:略
本题难度:简单
2、填空题 (11分)
(1)H2O2的水溶液为二元弱酸,科学家对H2O2结构的认识经历了较为漫长的过程,最初他们提出了两种观点:
a.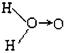 (式中O→O表示共用电子对由前一个氧原子提供)和 b.H—O—O—H
(式中O→O表示共用电子对由前一个氧原子提供)和 b.H—O—O—H
①请用电子式表示b的结构 。
②写出H2O2在水溶液中的电离方程式 。
(2)①用单质碘和氯酸钾可以制得碘酸钾,其中涉及的一个反应为:
I2 + KClO3 + H2O → KH(IO3)2 + KCl + Cl2↑.因此有人认为I2的氧化性强于氯气,你
(填“同意”或“不同意”)该观点,理由是 。
②用电化学方法也可以制碘酸钾.原理是以石墨为阳极,不锈钢为阴极,以碘化钾溶液为电解质溶液,在一定电流和温度下进行电解(同时不断搅拌电解质溶液)其电解总反应式为:

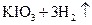 试写出阳极的电极反应式 。
试写出阳极的电极反应式 。
参考答案:
(1)①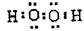 (2分)
(2分)
②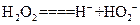 (2分)
(2分)
(2)①不同意(2分),因为碘在本反应中作还原剂,没有表现氧化性 (2分)
②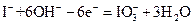 或
或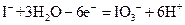 (3分)
(3分)
本题解析:略
本题难度:一般
3、选择题 在一种酸性溶液中存在NO3-、I-、CI-、Fe3+中一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推断溶液中(?)
①一定含有I-,不能确定是否有CI-?②一定含有NO3-
③不含有Fe3+?④一定含有I-、NO3-和CI-
A.①
B.②③
C.④
D.①③
参考答案:D
本题解析:略
本题难度:简单
4、填空题 填写下表中实验现象及结论:
| 实验操作 | 实验现象 | 离子方程式
?①将少量氯水加入盛有NaBr溶液的试管中,振荡后加入少量苯,振荡、静置
?②将少量溴水加入盛有KI溶液的试管中,振荡后加入少量四氯化碳,振荡、静置
|
结论:I2、Cl2、Br2三种单质的氧化性由强到弱的顺序为______.
参考答案:新制氯水中含有Cl2,可以置换出Br2和I2,Cl2+2NaBr=2NaCl+Br2 Cl2+2KI=2KCl+I2
Br2在苯中的溶解度远大于在水中的溶解度,所以发生萃取,其现象是:溶液从无色变为黄色,并且分层,下层为无色,上层黄色;
I2在CCl4中的溶解度远大于在水中的溶解度,所以发生萃取,其现象是:溶液从无色变为紫色,并且分层,下层为紫色,上层无色;
根据氧化剂的氧化性大于氧化产物的氧化性,Cl2+2NaBr=2NaCl+Br2 Cl2+2KI=2KCl+I2,Cl2>Br2,Br2>I2
故答案为:
实验操作实验现象化学方程式①静止分层,上层液体呈棕黄色下层液体呈无色. 2Br-+Cl2=2Cl-+Br2②静止分层,上层液体呈无色下层液体呈紫色. 2I-+Br 2=2Br-+I2I2、Cl2、Br2三种单质的氧化性由强到弱的顺序为 Cl2>Br2>I2.
本题解析:
本题难度:简单
5、填空题 由amolFe+bmolFe2O3组成的混和物,用足量的盐酸溶解。随着a/b的不同,反应产物各不相同。按照a/b的不同比值,结合有关氧化还原的反应竞争顺序,填写下列表格内容。表格可不填满,若不足可添加表格。
a/b
| 氧化还原反应主要产物
| 有关的离子方程式
|
?
| ?
| ?
|
?
| ?
| ?
|
?
| ?
| ?
|
?
| ?
| ?
|
?
| ?
| ?
参考答案:(14分,每个1分,)
a/b
氧化还原反应产物
有关的离子方程式
a/b<1
FeCl2
Fe2O3+6H+=2Fe3++3H2O;2Fe3++Fe=3Fe2+
a/b=1
FeCl2
Fe2O3+6H+=2Fe3++3H2O;2Fe3++Fe=3Fe2+
a/b>1
FeCl2?H2
Fe2O3+6H+=2Fe3++3H2O;2Fe3++Fe=3Fe2+;Fe+2H+=Fe2++H2↑
本题解析:本题所涉及到的常见氧化性离子的氧化性顺序为:Fe3+>H+;
当a=b时,Fe2O3+6H+=Fe3++3H2O,生成的Fe3+恰好被铁还原:2Fe3++Fe=3Fe2+;
当a>b时,铁过量,Fe2O3+6H+=Fe3++3H2O生成的Fe3+被部分铁还原:2Fe3++Fe=3Fe2+,余下的铁:Fe+2H+=Fe2++H2↑
当a<b时,铁不足,Fe2O3+6H+=Fe3++3H2O,生成的Fe3+被铁还原后仍有剩余:2Fe3++Fe=3Fe2+;
本题难度:一般
|