微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂.
(1)已知:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2.K2FeO4在处理水的过程中所起的作用有______、______.
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0mmol?L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ.该实验的目的是______;发生反应的△H______0(填“>”、“<”或“=”).
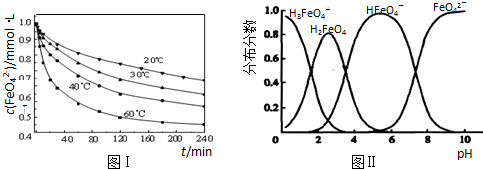
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示.下列说法正确的是______(填字母).
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O
(4)高铁酸钾还制作可充电电池,原理为:3Zn+2K2FeO4+8H2O
?3Zn(OH)2+2Fe(OH)3+4KOH,写出该电池充电时阳极电极反应式______.
参考答案:(1)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;
故答案为:杀菌消毒、吸附悬浮物;
(2)由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,温度越高FeO42-浓度越小,正向反应是吸热反应;
故答案为:探究温度对FeO42-浓度的影响;>;
(3)A、不同PH值时,溶液中铁元素的存在形态及种数不相同,比如在PH值等于6时,就只有两种形态,故A错误;
B、向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数先增大随后又减小,故B错误;
C、pH=6的这种溶液中,铁元素的存在形态有HFeO4-和FeO42-,加KOH溶液,只有HFeO4-能反应,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O,故C正确;
故答案为:C;
(4)反应原理为:3Zn+2K2FeO4+8H2O放电
本题解析:
本题难度:一般
2、选择题 在密闭容中发生下列反应aA(g)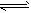 cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
[? ]
A.A的转化率变大
B.平衡向正反应方向移动
C.D的体积分数变大
D.a<c+d
参考答案:D
本题解析:
本题难度:一般
3、简答题 在一定温度下,容积为0.5L的密闭容器中,将一定量的二氧化氮和二氧化硫气体混合会发生如下反应:
NO2(g)+SO2(g)?NO(g)+SO3(g)
(1)该反应的平衡常数(K)表达式为______.
(2)该可逆反应达到平衡的标志是______(填下列序号字母?).
a.NO2、SO2、NO和SO3四种气体的物质的量浓度之比为1:1:1:1
b.密闭容器的压强不再发生变化
c.K值不再发生变化
d.生成n?mol SO2的同时,有n?mol SO3生成
(3)在上述平衡体系中通入少量O2,平衡______移动(填“向右”、“向左”或“不”之一);NO的浓度将______(填“增大”、“减小”或“不变”之一),c(NO)与c(NO2)之和______(填“增大”、“减小”或“不变”之一).
(4)若10min后容器内SO3气体质量为4g.则在10min内用NO2浓度的变化表示反应的平均反应速率为______?mol?(L?min)-1.
参考答案:(1)该可逆反应中化学平衡常数K=[NO][SO3][NO2][SO2],故答案为:K=[NO][SO3][NO2][SO2];
(2)a.当NO2、SO2、NO和SO3四种气体的物质的量浓度之比为1:1:1:1,该反应不一定达到平衡状态,这与反应物的初始浓度及转化率有关,所以不能证明该反应达到平衡状态,故错误;
b.该反应是一个反应前后气体体积不变的可逆反应,无论反应是否达到平衡状态密闭容器的压强始终不变,所以不能证明该反应是否达到平衡状态,故错误;
c.K值只与温度有关,温度不变K值不变,所以不能证明该反应是否达到平衡状态,故错误;
d.生成n?mol SO2的同时,有n?mol SO3生成,正逆反应速率相等,所以该反应达到平衡状态,故正确;
故选d;
(3)通入少量氧气,一氧化氮和氧气反应生成二氧化氮,一氧化氮浓度减小,二氧化氮浓度增大,平衡向正反应方向移动,根据原子守恒知c(NO)与c(NO2)之和不变,
故答案为:向右?减小?不变;
(4)若10min后容器内SO3气体质量为4g,三氧化硫的平均反应速率=4g80g/mol0.5L10min=0.01mol/(L.min),根据反应方程式知,二氧化氮的反应速率和三氧化硫的反应速率相等,为0.01mol/(L.min),故答案 为:0.01.
本题解析:
本题难度:一般
4、选择题 反应C(s)+H2O(g)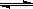 CO(g)+H2(g)在一可变容积的密闭容器内进行,达到平衡后,保持其他条件不变,下列条件的改变一定能使平衡移动的是
CO(g)+H2(g)在一可变容积的密闭容器内进行,达到平衡后,保持其他条件不变,下列条件的改变一定能使平衡移动的是
A.增加C的质量
B.保持体积不变,充入氦气使体系压强增大
C.加入催化剂
D.保持压强不变,充入氦气使容器体积增大