|
高考化学必考知识点《盐类水解的原理》高频考点巩固(2017年模拟版)(八)
2017-08-22 15:43:22
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 0.1?mol·L-1的下列物质的水溶液中,氢离子浓度最大的是
A.NH3·H2O
B.NH4Cl
C.HCl
D.HCOOH
参考答案:C
本题解析:盐酸是强酸,盐所以盐酸溶液中氢离子的浓度最大,酸性最强。答案选C。
本题难度:一般
2、选择题 25℃时,下列溶液中,离子浓度关系正确的是
A.pH=a的氨水稀释10倍后,其pH=b,则a=b+1
B.浓度相同的①NH4Cl ②CH3COONH4 ③NH4HSO4,三种溶液中的c(NH4+):①>③>②
C.将相同浓度的氨水与盐酸等体积混合,所得溶液中的离子浓度关系:c (NH4+)> c (Cl-) > c (H+) > c (OH-)
D.将a mol·L-1CH3COOH与b mol·L-1NaOH溶液等体积混合,测得溶液pH为7,则a与b的关系:a>b
|
参考答案:D
本题解析:A、一水合氨为弱电解质,加水稀释促进电离,pH=a的氨水稀释10倍后,其pH=b,则a<b+1,错误;B、CH3COONH4中醋酸根水解呈碱性,常见铵离子的水解,NH4HSO4电离出的氢离子抑制铵离子的水解,故浓度相同的①NH4Cl ②CH3COONH4 ③NH4HSO4,三种溶液中的c(NH4+):③>①>②,错误;C、将相同浓度的氨水与盐酸等体积混合,二者恰好完全反应,所得溶液为氯化铵溶液,离子浓度关系:c (Cl-) >c (NH4+)> c (H+) > c (OH-),错误;D、等浓度等体积的醋酸和氢氧化钠溶液混合二者恰好完全反应生成醋酸钠,溶液呈碱性,现混合液呈中性,则溶液为醋酸钠和醋酸的混合液,则a与b的关系:a>b,正确。
考点:考查弱电解质的电离和盐类的水解。
本题难度:一般
3、选择题 现有1.0 mol/L的NaOH溶液0.1L,若通入标准状况下体积为2.24L 的SO2气体,使其充分反应后,则所得溶液中各粒子浓度大小关系正确的是
A.c(Na+)+c(H+) = c(HSO3―) +c(SO32―) + c( OH―)
B.c(Na+) = c(H2SO3) + c(HSO3―) + c ( H+)
C.c(SO32―) + c( OH―) = c(H+) + c(H2SO3)
D.c(Na+)>c(HSO3―)>c( OH―)>c(H2SO3)>c(SO32―)>c(H+)
参考答案:C
本题解析:试题分析:n(SO2)=2.24L÷22.4L/mol=0.1mol, n(NaOH)=0.1L×1mol/L=0.1mol,二者反应的化学方程式为SO2+NaOH=NaHSO3,反应后为NaHSO3溶液,则
溶液存在电荷守恒,则应有c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),故A不正确;根据物料守恒,则c(HSO3-)+c(SO32-)+c(H2SO3)=c(Na+)=1mol?L-1,所以B不正确;根据物料守恒和电荷守恒可知,c(SO32―) + c(OH-)=c(H+)+c(H2SO3),C正确;HSO3-的电离程度大于水解程度,溶液显酸性,所以选项D不正确,答案选C。
考点:考查离子浓度大小比较
点评:该题是高考中的常见题型,属于中等难度试题的考查。本题注意根据反应物的物质的量判断反应物,比较离子浓度大小关系时,常常用到电荷守恒、物料守恒以及质子守恒等方法,做题时注意体会和总结。
本题难度:简单
4、选择题 下列有关溶液中微粒的物质的量浓度的关系,正确的是
A.0.1 mol·L-1的NH4Cl溶液与0.05 mol·L-1的NaOH溶液等体积混合的溶液:c(Cl-)>c(Na+)>c(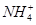 )>c(OH-)>c(H+) )>c(OH-)>c(H+)
B.等物质的量的NaClO、NaHCO3混合溶液:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(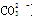 ) )
C.pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+)
D.某二元弱酸的酸式盐NaHA溶液:c(OH-)+c(H2A)=c(H+)+2c(A2-)
参考答案:B
本题解析:A、0.1 mol·L-1的NH4Cl溶液与0.05 mol·L-1的NaOH溶液等体积混合的溶液,得到等浓度的氯化铵、一水合氨、氯化钠的混合液,溶液呈碱性,所以溶液中的离子浓度的大小关系是c(Cl-)> >c(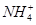 )>c(Na+)>c(OH-)>c(H+),错误;B、等物质的量的NaClO、NaHCO3混合溶液中,根据物料守恒,可得c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c( )>c(Na+)>c(OH-)>c(H+),错误;B、等物质的量的NaClO、NaHCO3混合溶液中,根据物料守恒,可得c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(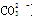 ),正确;C、因为酸、碱的强弱未知,所以混合后溶液的酸碱性不能确定,错误;D、根据质子守恒,应有c(OH-)=c(H+)-c(A2-)+ c(H2A),则c(OH-)+c(A2-)=c(H+)+c(H2A),错误,答案选B。 ),正确;C、因为酸、碱的强弱未知,所以混合后溶液的酸碱性不能确定,错误;D、根据质子守恒,应有c(OH-)=c(H+)-c(A2-)+ c(H2A),则c(OH-)+c(A2-)=c(H+)+c(H2A),错误,答案选B。
考点:考查溶液混合的计算,离子浓度的比较,守恒规律的应用
本题难度:困难
5、实验题 某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol/L的MgCl2溶液中各加入10滴2 mol/L NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
实验序号
| 加入试剂
| 实验现象
| Ⅰ
| 4 mL 2mol/LNH4Cl 溶液
| 沉淀溶解
| Ⅱ
| 4 mL蒸馏水
| 沉淀不溶解
|
(1)测得实验Ⅰ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因 。
(2)同学们猜测实验Ⅰ中沉淀溶解的原因有两种:
猜想1:氢氧化镁电离出OH-离子,与氯化铵电离出来的铵根离子反应生成氨水.
猜想2: 。
(3)为验证猜想,又设计了以下实验
序号
| 实验内容
| 结 果
| 1
| 测定醋酸铵溶液的pH
| pH约为7,溶液呈中性
| 2
| 取少量的相同质量的氢氧化镁分别盛放在试管中,分别向其中滴加醋酸铵溶液和氯化铵溶液
| 固体均溶解
|
①用醋酸铵溶液与氢氧化镁反应的原因是 。
②实验证明猜想正确的是 (填“1”或“2”)。
(4)实验Ⅱ观察到沉淀不溶解。该实验的目的是 。
参考答案:(1)NH4+ + H2O 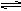 NH3·H2O + H+;(2)氯化铵中NH4+离子水解出的H+,与氢氧化镁电离出OH-离子生成了水;(3)①醋酸铵溶液呈中性,如果氢氧化镁能溶解于醋酸铵,说明是NH4+结合氢氧化镁电离出的OH-离子,导致沉淀溶解平衡移动正向移动,达到沉淀溶解; ② 1;(4)做对比分析,排除实验中溶剂水使沉淀溶解的可能性 NH3·H2O + H+;(2)氯化铵中NH4+离子水解出的H+,与氢氧化镁电离出OH-离子生成了水;(3)①醋酸铵溶液呈中性,如果氢氧化镁能溶解于醋酸铵,说明是NH4+结合氢氧化镁电离出的OH-离子,导致沉淀溶解平衡移动正向移动,达到沉淀溶解; ② 1;(4)做对比分析,排除实验中溶剂水使沉淀溶解的可能性
本题解析:(1)NH4Cl是强酸弱碱盐,NH4+水解NH4++H2O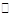 NH3·H2O+H+,c(H+)>c(OH-),溶液显酸性;(2)NH4Cl溶液显酸性,可能是氢氧化镁电离出的OH-与NH4+水解产生的H+发生反应,促使氢氧化镁溶解;(3)①醋酸铵溶液呈现中性,如果氢氧化镁溶解,说明是氢氧化镁电离出的OH-与NH4+结合成NH3·H2O,猜想1正确;如果氢氧化镁不溶解,说明猜想2正确,根据实验把氢氧化镁加入到醋酸铵溶液中,沉淀溶解,说明猜想1正确;(4)做对比实验,说明氢氧化镁不溶于水,溶于NH4Cl溶液,不是水的缘故。 NH3·H2O+H+,c(H+)>c(OH-),溶液显酸性;(2)NH4Cl溶液显酸性,可能是氢氧化镁电离出的OH-与NH4+水解产生的H+发生反应,促使氢氧化镁溶解;(3)①醋酸铵溶液呈现中性,如果氢氧化镁溶解,说明是氢氧化镁电离出的OH-与NH4+结合成NH3·H2O,猜想1正确;如果氢氧化镁不溶解,说明猜想2正确,根据实验把氢氧化镁加入到醋酸铵溶液中,沉淀溶解,说明猜想1正确;(4)做对比实验,说明氢氧化镁不溶于水,溶于NH4Cl溶液,不是水的缘故。
考点:考查盐类水解等相关知识。
本题难度:困难
|