微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是( )
A.950mL 111.2g
B.500mL 117.0g
C.任意规格 111.2g
D.1000mL 117.0g
参考答案:D
本题解析:
本题难度:简单
2、简答题 某同学配置100ml浓度为1mol?L-1的Na2CO3溶液,并进行有关实验,请回答下列问题:
(1)需要称量碳酸钠的质量为______g
(2)配置该碳酸钠溶液时使用的仪器除天平、烧杯、胶头滴管外,还必须用到的玻璃仪器有______、______.
(3)在操作过程中,该同学转移液体后未经洗涤烧杯就加水定容至刻度线,则所配置溶液的浓度将______?(填“偏大”、“偏小”、或“不变”)
(4)在定容这一操作中,应在距刻度线______处,改用胶头滴管滴加蒸馏水至容量瓶内液体的______与刻度线保持水平.
参考答案:(1)实验室配制100ml 1mol/LNa2CO3溶液需要Na2CO3的质量为:0.1L×1mol/L×106g/mol=10.6g,
故答案为:10.6;
(2)反应操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,在烧杯中溶解,冷却后转移到100ml容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以还需要的仪器为100mL容量瓶、胶头滴管,故答案为:100mL容量瓶;玻璃棒;
(3)未经洗涤烧杯就加水定容至刻度线,会导致溶质的物质的量偏小,溶液浓度偏低,故答案:偏小;
(4)定容时,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面最低处与刻度线保持水平,故答案为:1-2cm;凹液面最低处.
本题解析:
本题难度:一般
3、简答题 实验室用NaCl固体配制1mol/L的NaCl溶液500mL,回答下列问题:
(1)请写出该实验的实验步骤:①计算,②称量,③______,④冷却,⑤______,⑥洗涤,⑦定容,⑧摇匀.用托盘天平称量样品时,若指针偏向右边,则表示______(填“左盘”或“右盘”)重.
(2)所需主要仪器为:托盘天平、药匙、500mL容量瓶、胶头滴管、______.
(3)从配制好的溶液中取出50mL,其中NaCl的物质的量浓度为______.
参考答案:(1)配制1mol/L的NaCl溶液500mL的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等;使用托盘天平时,药品放在左盘,砝码放在右盘,若指针偏向右边,说明右边的砝码较重,
故答案为:溶解;移液(转移);右盘;
(2)配制500mL 1mol/L的NaCl溶液使用的仪器为:托盘天平、药匙、500mL容量瓶、胶头滴管、烧杯、玻璃棒,还缺少烧杯和玻璃棒;
故答案为:烧杯、玻璃棒;
(3)配制好的溶液中取出50mL,由于溶液是均一的,所以NaCl的物质的量浓度还是1mol/L,
故答案为:1mol/L.
本题解析:
本题难度:一般
4、简答题 配制480mL1mol/LNaOH溶液时:
(1)需要______mL的容量瓶.
(2)下列哪些操作会使实验结果偏高______,偏低______,无影响______.
A.振荡,摇匀溶液后,发现液面低于刻度线,再补加水
B.称量时,固体放在右盘,砝码放在左盘(未用游码)
C.原容量瓶洗涤后未干燥D.定容时俯视刻度线
E.移液时,未洗涤烧杯和玻璃棒
F.在烧杯中溶解NaOH固体后,未冷却立即将溶液注入容量瓶中.
参考答案:解(1)配制480mL溶液,需要选用500mL容量瓶,故答案为:500;
(2)A.再补加水,导致加入的蒸馏水体积偏大,配制的溶液浓度偏低;
B.称量NaOH时,砝码错放在左盘(未用游码),称量的氢氧化钠质量不变,配制的溶液的浓度不变;
C.配制前,容量瓶中有少量蒸馏水,对溶质的物质的量及最终溶液体积没有影响,所以不影响配制结果;
D.定容时俯视刻度线,导致加入的蒸馏水体积偏小,配制的溶液浓度偏高;
E.移液时,未洗涤烧杯和玻璃棒,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏小;
F.未冷却,由于热胀冷缩,导致所配溶液体积偏小,故所配溶液浓度偏大;
故答案为:D、F;A、E;B、C.
本题解析:
本题难度:一般
5、选择题 体积为V?mL、密度为ρ?g/cm3的溶液,含有相对分子质量为M的溶质m?g,其物质的量浓度为c?mol/L,溶质的质量分数为W%,下列表示式中正确的是
A.c=
B.m=
C.W%=%
D.c=
参考答案:BD
本题解析:分析:根据溶液的质量为ρV,溶质的质量等于溶液的质量与质量分数的乘积,以及c= 来计算.
来计算.
解答:A.根据c=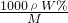 可知,c=
可知,c=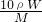 ,故A错误;
,故A错误;
B.溶液的质量为ρV,溶质的质量等于溶液的质量与质量分数的乘积,则m=ρV×W%=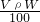 ,故B正确;
,故B正确;
C.质量分数等于溶质质量与溶液质量的比,则W%=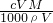 ×100%=
×100%=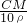 %,故C错误;
%,故C错误;
D.根据c= 可知,c=
可知,c= =
= ,故D正确;
,故D正确;
故选BD.
点评:本题考查物质的量浓度的有关计算,明确质量、物质的量、质量分数与物质的量浓度之间的关系及计算公式即可解答,难度不大.
本题难度:一般