| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《难溶电解质的溶解平衡》考点特训(2017年冲刺版)(四)
参考答案:D 本题解析:A、实验②滴加饱和Na2S溶液出现浑浊,证明了①的滤液中含有Ag+,根据电荷守恒可由此推断①的滤液中也含有Cl¯,A正确;B、实验②证明了该温度下Ag2S比Ag2SO4更难溶解,B正确;C、实验③的溶液生成银氨溶液,含有Ag(NH3)2+微粒,C正确;D、由实验③推测:使沉淀溶解是因为含有氨生成了银氨溶液,不是与氢氧根离子反应,D错误;答案选D。 本题难度:困难 4、选择题 已知:25°C时,KSP[Mg(OH)2]=5.61×10—12,KSP[MgF2]=7.42×10—11。下列说法正确的是(?) 参考答案:B 本题解析:氢氧化镁的溶度积常数小于氟化镁的,所以A不正确。由于氯化铵溶于水,电离出NH4+能结合溶液中OH-,促进氢氧化镁的溶解,B正确。溶度积常数只与温度有关系,C不正确。只要溶液中c(Mg2+)·c2(OH-)>KSP[MgF2],就会有氟化镁沉淀析出,D不正确。答案选B。 本题难度:一般 5、填空题 某自来水中含有Ca2+、Mg2+、Na+、K+、、HCO32-、SO42-、Cl—,长期烧煮上述自来水会在锅炉内形成水垢。锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。已知部分物质20℃时的溶解度数据为: |
参考答案:(1)Mg(HCO3)2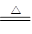 MgCO3↓+H2O+CO2↑,? MgCO3+H2O
MgCO3↓+H2O+CO2↑,? MgCO3+H2O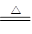 Mg(OH)2+CO2↑
Mg(OH)2+CO2↑
(2)C?(3)0.01mol/L
本题解析:(1)因为在加热的条件下碳酸氢镁会分解生成碳酸镁,继续加热,碳酸镁可以和水发生水解反应生成氢氧化镁。
(2)钙的碳酸盐易溶于盐酸,所以可加入碳酸钠,生成碳酸钙而除去。
(3)10ml自来水中含有钙离子的物质的量是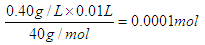 ,
,
同时消耗M也是0.0001mol。M总的物质的量是0.01mol.L×0.02L=0.0002mol,所以和镁离子反应的M是0.0002mol-0.0001mol=0.0001mol,则镁离子是0.0001mol,所以其浓度为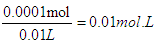
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《氯及其化合.. | |