微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室常用硫酸铜溶液吸收气体中的硫化氢:CuSO4+H2S=CuS↓+H2SO4,该反应可以推测
A.CuS易水解
B.CuS可溶于盐酸
C.相同温度下氢硫酸饱和溶液中硫离子(S2-)浓度比CuS饱和溶液中大
D.强酸可以制取弱酸
参考答案:C
本题解析:根据沉淀转化以及溶度积常数的含义可知,该反应能够发生,这说明相同温度下氢硫酸饱和溶液中硫离子(S2-)浓度比CuS饱和溶液中大,从而可以生成硫化铜沉淀,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。该题基础性强,侧重对学生解题能力的培养和训练,有利于培养学生的逻辑推理能力和应试能力。
本题难度:简单
2、选择题 已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定。

滴定时,你认为该滴定适宜选用的指示剂是
[? ]
A.KBr
B.KI
C.K2S
D.K2CrO4
参考答案:D
本题解析:
本题难度:一般
3、选择题 在溶液中有浓度均为0.01mol·L-1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:
Ksp[Fe(OH)3] =2.6×10-39;?Ksp[Cr(OH)3] =7.0×10-31;
Ksp[Zn(OH)2] =1.0×10-17;?Ksp[Mg(OH)2] =1.8×10-11;
当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小
A.Fe3+
B.Zn2+
C.Cr3+
D.Mg2+
参考答案:A
本题解析:利用溶度积来计算每个选项的氢氧根离子的物质的量,物质的量最大的,PH最大,最小的PH最小。计算出PH后开始比较得A>B>C>D。
点评:简单的化学计算,可以运用更简单的方法,难度不大。
本题难度:一般
4、填空题 根据以下信息回答下列问题。
Ⅰ .盐碱地(含较多NaCl、Na2CO3)不利于作物生成,通过施加适量石膏(CaSO4)可以降低土壤的碱性。
.盐碱地(含较多NaCl、Na2CO3)不利于作物生成,通过施加适量石膏(CaSO4)可以降低土壤的碱性。
Ⅱ.长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用盐酸除去。
①请用离子方程式表示盐碱地产生碱性的原因:?;
②请用化学方程式表示 加入石膏降低土壤碱性的反应原理?;
加入石膏降低土壤碱性的反应原理?;
③请写出水垢悬浊液中CaSO4溶解平衡的离子方程式?;
④ 请分析水垢中的CaSO4转化为CaCO3的原理?;
请分析水垢中的CaSO4转化为CaCO3的原理?;
⑤请写出CaCO3溶于过量盐酸的离子方程式?。
参考答案:①CO32-+H2O 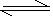 ?HCO3-+OH-, HCO3-+H2O
?HCO3-+OH-, HCO3-+H2O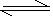 H2CO3+OH-
H2CO3+OH-
②CaSO4+Na2CO3=CaCO3+ Na2SO4
③ CaSO4(s)  Ca2+(aq)+SO42-(aq)
Ca2+(aq)+SO42-(aq)
④CaSO4的沉淀溶解平衡,加入Na2CO3溶液后,CO32- 与Ca2+结合生成更难溶于水的CaCO3沉淀,Ca2+浓度减少,使CaSO4的沉淀溶解平衡向溶解方向移动,CaSO4沉淀减少,CaCO3沉淀生成。
⑤CaCO3 +2H+= CO2↑+ H2O +Ca2+
本题解析:略
本题难度:简单
5、选择题 某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示:下列有关Ag2SO4说法正确的是
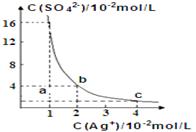
A.含有大量SO42-的溶液中肯定不存在Ag+
B.Ag2SO4的溶度积常数(Ksp)为8×10-4
C.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
D.0.02mol?L-1的AgNO3溶液与0.2mol?L-1的Na2SO4溶液等体积混合不会生成沉淀