微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 地下水中硝酸盐造成的氮污染已成为一个世界性的环节问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
(1)实验前:①先用0.1mol·L-1H2SO4洗涤Fe粉,其目的是____________________________,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入__________________________(写化学式)。
(2)下图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式________________________________。t1时刻后,该反应仍在进行,溶液中NH的浓度在增大,Fe2+的浓度却没有增大,可能的原因是______________________________________。

(3)该课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三:
假设一:溶液的pH;
假设二:__________________________________________;
假设二:__________________________________________;
……
(4)请你设计实验验证上述假设一,写出实验步骤及结论。(已知:溶液中的NO3-浓度可用离子色谱仪测定)

参考答案:(1)去除铁粉表面的氧化物等杂质;N2
(2)4Fe+NO+10H+=2Fe+NH+3H2O;生成Fe的水解(或和溶液中的OH-结合)
(3)温度;铁粉颗粒大小
(4)
本题解析:
本题难度:一般
2、填空题 (12分)甲、乙两人分别用不同的方法配制100mL 3.6mol/L的稀硫酸。
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为?
(2)甲:量取18 mol/L的浓硫酸?mL,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL 容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小 心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①实验所用的玻璃仪器除烧杯和容量瓶外,还有?、?、?;
②使用容量瓶前必须进行的一步操作是?
③ 定容的正确操作是?
(3)乙:用100 mL量筒量取20 mL浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加水至100 mL 刻度线,再搅拌均匀。
你认为此法是否正确?若不正确,指出其中 错误之处?
错误之处?
参考答案:(12分)(1)②①③⑧⑤⑥⑦④ (2分,错排不得分)
(2)20 (2分)?① 量筒、玻璃棒、胶头滴管(3分,每个1分);② 检查是否漏水(1分);③ 加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切(2分)。
(3)不能用量筒配制溶液,不能将水加入到浓硫酸中(2分)
本题解析:略
本题难度:一般
3、实验题 (16分)实验室需要0.1 mol·L-1NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
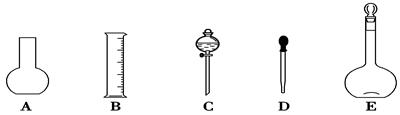
(1)如图所示的仪器中配制溶液肯定不需要的是____________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)下列是通过使用质量分数为98%(密度为1.84 g·cm-3)的浓硫酸来配制500 mL 0.5 mol·L-1硫酸溶液的操作步骤,其正确的操作顺序是??(填序号)。
A.把容量瓶活塞塞上,反复摇匀后,装贴标签以保存
B.加入蒸馏水进容量瓶中进行定容,待水面离刻度线只有1~2厘米时,采用胶头滴管滴加蒸馏水使其凹液面正好与刻度线相切
C.在烧杯中注入适量的蒸馏水,用量筒准确量取98%的浓硫酸13.3ml慢慢注入烧杯中,并不停地搅拌使之稀释均匀
D.通过计算需要量取98%(密度为1.84 g·cm-3)的浓硫酸13.3ml
E.待烧杯中稀释的硫酸溶液冷却至室温后,通过玻璃棒引流转移至500ml的容量瓶中
F.把玻璃棒和烧杯分别都洗涤2~3 次,洗涤液也转移至容量瓶
次,洗涤液也转移至容量瓶
(3)根据计算用 托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1 mol·L-1?(填“大于”“等于”或“小于”,下同);若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________0.1 mol·L-1;溶解NaOH后在未降至室温时,立即将N
托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1 mol·L-1?(填“大于”“等于”或“小于”,下同);若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________0.1 mol·L-1;溶解NaOH后在未降至室温时,立即将N aOH溶液转移至容量瓶定容,则所得溶液浓度_______ 0.1 mol·L-1。
aOH溶液转移至容量瓶定容,则所得溶液浓度_______ 0.1 mol·L-1。
(4)在容量瓶的使用方法中,下列操作不正确的是?(填写标号).
A.使用容量瓶前检查它是否漏水.
B.容量瓶用蒸馏水洗净后,不需要进行烘干就可以直接使用.
C.配制溶液时,如果 试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线.
试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线.
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线.
参考答案:
本题解析:略
本题难度:一般
4、实验题 硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。

已知溶液的pH =3.7时,Fe3+已经沉淀完全;NH3·H2O电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为
1× 10-3 mol·L-1。请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式:___。
(2)上述流程中两次使用试剂①,推测试剂①应该是___(填序号)。
A.氢氧化钠溶液
B.氧化铝
C.氨水
D.水
(3)从溶液D到固体E的过程中需要控制溶液pH =13,如果pH过小,可能导致的后果是____ (任写一点)。
(4)溶液H中溶质的化学式为___。
(5)计算溶液F中c(Mg2+)=___(25℃时,Ksp[Mg(OH)2]=5.6×10 -12)。
参考答案:(l)SiO2+2NaOH==Na2SiO3 +H2O
(2)A
(3)镁离子沉淀不完全或氢氧化铝溶解不完全等
(4) NaHCO3、NaCl
(5)5.6×10-10 mol·L-1
本题解析:
本题难度:一般
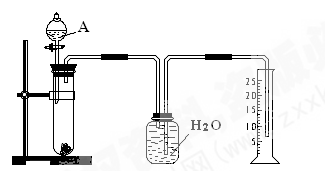
5、实验题 (6分)某同学设计了一个简单的实验(如图所示),以测定镁铝合金中铝的质量分数。可供选用的试剂有:浓H2SO4、浓硝酸、6 mol·l-1 NaOH溶液。
请填写下列空白:
(1)有关实验操作:a、往试管中放入适量的铝合金样品;b、从分液漏斗往试管中加入过量的A溶液;c、检查装置的气密性;d、测定收集到的水的体积。
正确的操作顺序为_________________________________________。
(2)A溶液可选用________________________________________
(3)若实验中测得样品的质量为W g ,氢气的体积为a L(标准状况),则样品中Al的质量分数为_______________________________________。
参考答案:

本题解析:略
本题难度:一般