微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质的分离方法正确的是?
[? ]
①用升华法分离碘和氯化铵的混合物?
②用结晶法分离硝酸钾和氯化钠的混?合物
③用分液法分离水和硝基苯的混合物?
④用蒸馏法分离乙醇(沸点为78.5℃)和乙酸乙酯(沸点为77.5℃)的混合物
A.①②?
B.②③ ?
C.③④?
D.②④
参考答案:B
本题解析:
本题难度:简单
2、选择题 用下列实验装置进行相应实验,装置正确且能达到实验目的的是

A.用图a所示装置干燥SO2气体
B.用图b所示装置蒸发CH3COONa溶液得醋酸钠晶体
C.用图c所示装置分离有机层与水层,水层从分液漏斗下口放出
D.用图d所示装置测量氯气的体积
参考答案:B
本题解析:用干燥管干燥气体,应从口径较大的一端进气,故A错误;分离分液漏斗中分层液体时,应上层液体从上口倒出,即水层从上口倒出,故C错误;使用该装置量取气体体积时,应保证量筒内的页面和广口瓶内的液面相平,故D错误。
本题难度:一般
3、选择题 对于某些离子的检验及其结论一定正确的是(? )
A.加入稀盐酸产生无色无味气体,将气体通入石灰水中,变浑浊,一定有CO32-
B.加入BaCl2溶液产生白色沉淀,再加上稀盐酸沉淀不消失,一定有SO42-
C.加入足量稀盐酸无沉淀,再加BaCl2溶液有白色沉淀,一定有SO42-
D.加入Na2CO3溶液产生白色沉淀,再加稀盐酸白色沉淀消失,一定有Ba2+
参考答案:C
本题解析:A.加入稀盐酸产生无色无味气体,将气体通入石灰水中,变浑浊,则溶液中可能含有CO32-也可能含有HCO32-。错误。B.加入BaCl2溶液产生白色沉淀,再加上稀盐酸沉淀不消失,可能含有Ag+,也可能有SO42-。错误。C.加入足量稀盐酸无沉淀,排除了含有Ag+的可能;再加BaCl2溶液有白色沉淀,则一定有SO42-。正确。D.加入Na2CO3溶液产生白色沉淀,再加稀盐酸白色沉淀消失,可能含有Ca2+,也可能是一有Ba2+。错误。32-、SO42-、 Ba2+等离子的检验方法的知识。
本题难度:一般
4、选择题 某10%NaOH溶液,加热蒸发掉100 g水后得到80 mL20%的溶液,则该20%NaOH溶液的物质的量浓度为
A.6.25 mol·L-1
B.12.5 mol·L-1
C.7 mol·L-1
D.7.5 mol·L-1
参考答案:A
本题解析:设未蒸发前原溶液质量为x g,由题意得x×10%=(x-100)×20%,解得x=200 g.
则20%NaOH溶液的物质的量浓度为200×10%/40×0.08=6.25(mol·L-1).
本题难度:困难
5、实验题 氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2 ? 2H2O)。

(1)为了完成步骤I,可采用如下图所示的装置将粗铜转化为固体a。
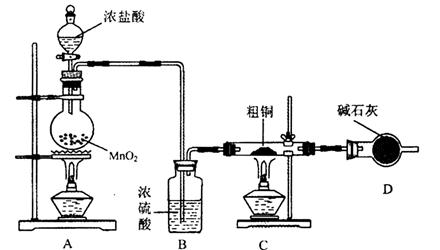
在该实验中,加热A、C装置中的酒精灯时,应该先点燃_______装置的酒精灯,D装置的作用是
_______,C装置中生成的产物是_______。
(2)步骤II中的操作是:将步骤I中的固体加入到容器中,然后加入_______,固体完全溶解。
(3)步骤III中加入的试剂是H2O2,其目的是提高最终制备的氯化铜晶体的纯度,试写出有关反应的离子方程式______________。
(4) 步骤IV中应先加入某试剂,然后过滤得到滤液。为了调节溶液的pH只使Fe3+完全沉淀,加入的试剂是CuO粉末而不用氨水或NaOH溶液,其理由是_______。
(5)步骤V中,将溶液蒸发浓缩、冷却结晶、过滤得到CuCl2·2H2O晶体。现欲得到无水CuCl2,在实验室也可以采用上述装置完成CuCl2 ? 2H2O脱水得到无水CuCl2,则A装置中的两种化学试剂是_____。
参考答案:(每空2分,共计14分)(1)A;吸收尾气;CuCl2、FeCl3?(2)稀盐酸
(3)H2O2+2Fe2++2H+=2Fe3++2H2O
(4)加入的氨气或NaOH溶液引入杂质,且试剂的量不容易控制
(5)浓硫酸、氯化钠晶体(或浓盐酸)
本题解析:(1)由于装置中含有空气,在加热的条件下,空气能氧化单质铜。所以要首先加热A处的酒精灯,利用生成的氯气将空气排尽;由于氯气有毒,所以小于尾气处理,因此D装置中碱石灰的作用是吸收尾气;粗铜中含有铁,因此在加热的条件下,两种金属均能和氯气发生化合反应,所以C装置中生成的产物是CuCl2、FeCl3。
(2)由于氯化铜和氯化铁在溶液中均发 91ExAm.org生水解反应,所以溶解固体使应该用稀盐酸溶解。
(3)双氧水具有氧化性,可以把溶液中的亚铁离子氧化生成铁离子而除去,反应的离子方程式是H2O2+2Fe2++2H+=2Fe3++2H2O。
(4)根据流程可知,加入试剂的目的是用于调节pH以除去杂质铁离子。NaOH引入杂质钠离子,NH3?H2O会入杂质铵根离子,且二者的用量不容易控制,因此一般用氧化铜而不用氨水或氢氧化钠溶液。
(5)由于氯化铜水解生成氢氧化铜和氯化氢,所以在加热时应该在氯化氢中的气氛中完成,所以A装置的作用就是制备氯化氢,因此需要的两种化学试剂是浓硫酸和氯化钠晶体。
本题难度:一般