微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O中,氧化产物是_________,还原产物是_________,1 mol氧化剂在反应中得到电子的物质的量为_________。
参考答案:CuI;I2;11mol
本题解析:
本题难度:一般
2、选择题 下列电子转移的表示方法中正确的是
[? ]
A. 
B. 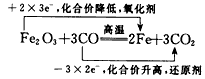
C. 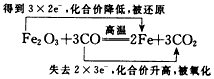
D. 
参考答案:D
本题解析:
本题难度:简单
3、选择题 关于反应: 4Al+3TiO2+3C=2Al2O3+3TiC的叙述中正确的是
A.Al是还原剂,TiC是氧化产物
B.TiO2是氧化剂,TiC是还原产物
C.反应中氧化剂与还原剂的物质的量之比是1:1
D.生成1molTiC转移4mol电子
参考答案:D
本题解析:根据方程式可知,Al的化合价从0价升高到+3价,失去3个电子,铝是还原剂,氧化铝是氧化产物;碳元素的化合价从0价降低到-4价,得到4个电子,所以碳是氧化剂,TiC是还原产物,所以只有选项D正确。
本题难度:简单
4、选择题 若某反应的方程式为:A+酸===盐+水,则A不可能属于( )
A.氧化物
B.碱
C.单质
D.电解质
参考答案:C
本题解析:单质和酸反应不可能是盐和水,其余都是可能的,答案选C。
本题难度:一般
5、填空题 实验室模拟用工业废弃固体(含有 、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(
、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(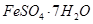 )和明矾[Kal(SO4)2
)和明矾[Kal(SO4)2 12H2O]的操作流程如下:
12H2O]的操作流程如下:

(1)试剂x是_________(写化学式)。
(2)配平下列方程式:
____
(4)为了分析产品(绿矾)中铁元素的含量,某同学称取20.0g样品配成100mL溶液,移取25.00mL用 标准溶液进行滴定(MnO
标准溶液进行滴定(MnO 被还原为
被还原为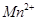 )。
)。
请回答下列问题:
①滴定时,KmnO4标准溶液应盛放在______________(填仪器名称)中。
②若达到滴定终点消耗KmnO4标准溶液体积为25.00mL,则该产品中铁元素的质量分数为_________。
参考答案:(1)H2SO4(或KHSO4)(2分)
(2)蒸发浓缩(或加热浓缩,或浓缩)、冷却结晶(4分)
(3)2、5、2、2、5、4(3分)
(4)①酸式滴定管(2分)?②14%(3分)
本题解析:(1)加入KOH后,溶液B含有K[Al(OH)4],而最后产物为明矾,所以X为H2SO4(或KHSO4)。
(3)根据化合价升降法即可配平化学方程式。
(4)①高锰酸钾具有强氧化性,能氧化橡胶管,只能盛放在酸式滴定管中;
②根据电子守恒可知:KMnO4→5Fe2+,20.0样品中含铁:0.025L×0.1mol/L×5×4×56g/mol=2.8g,进而求出铁元素的质量分数。
本题难度:一般