微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 室温下,下列各组离子在指定溶液中能大量共存的是
[? ]
A.饱和氯水中 Cl-、NO3-、Na+、SO32-
B.c(H+)=1.0×10-13mol/L溶液中 C6H5O-、K+、SO42-、Br-
C.Na2S溶液中 SO42-、K+、Cl-、Cu2+
D.pH=12的溶液中 NO3-、I-、Na+、Al3+
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列溶液中有关物质的量浓度关系和计算不正确的是
A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有
c(NaOH) < c(NaHCO3) < c(CH3COONa)
B.已知25℃时Ksp(AgCl)=1.8×10-10,则在0.1mol/LA1C13溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol/L
C.25℃时,0.1mol/LNa2CO3溶液中水电离出来的OH-浓度大于0.1mol/L NaOH溶液中水电离出来的OH-浓度
D.室温下,0.1mol/LNaHA溶液的pH=4,则有c(HA-)>c(H+)>c(H2A)>c(A2-)
参考答案:D
本题解析:氢氧化钠属于强碱,CH3COONa和NaHCO3属于强碱弱酸盐,水解显碱性,因为醋酸的酸性强于碳酸的,所以相同浓度的CH3COONa和NaHCO3相比,前者的水解程度小于后者,即碱性弱于后者,因此A正确。在0.1mol/LA1C13溶液中。Cl-浓度是0.3mol/L,根据溶度积常数的概念可知,Ag+的物质的量浓度最大为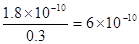 ,B正确。在溶液中Na2CO3水解,从而促进水的电离,而NaOH是强碱,在溶液中抑制水的电离,C正确。0.1mol/LNaHA溶液的pH=4,说明HA-的电离程度大于其水解程度,所以正确的顺序是c(HA-)>c(H+)>c(A2-)>c(H2A),D不正确。答案选D。
,B正确。在溶液中Na2CO3水解,从而促进水的电离,而NaOH是强碱,在溶液中抑制水的电离,C正确。0.1mol/LNaHA溶液的pH=4,说明HA-的电离程度大于其水解程度,所以正确的顺序是c(HA-)>c(H+)>c(A2-)>c(H2A),D不正确。答案选D。
本题难度:简单
3、选择题 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Mg2+、Al3+等离子。当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如下图所示。由此可知原溶液中
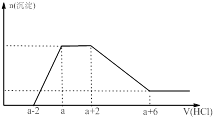
A.不含SO42-
B.含有的阴离子一定是OH-、AlO2-、SiO32-
C.含有的阴离子一定是OH-、CO32-、AlO2-、SiO32-
D.含有AlO2-与SiO32-的物质的量之比为3:1
参考答案:C
本题解析:当向某溶液中加入一定物质的量浓度的盐酸时,开始无沉淀,说明溶液中含有大量的OH-;由于OH-与Mg2+、Al3+会发生离子反应,所以不能大量存在。此后随着HCl的滴加,沉淀逐渐增多,当沉淀达到最大值后再继续滴加,沉淀的质量不改变,也不减少,说明该溶液中含有能与H+发生反应的微粒,只有含CO32-,在此阶段发生反应:2H++CO32-=H2O+CO2↑。后来沉淀又有所减少,但仍然存在沉淀,说明沉淀中含有Al(OH)3、H2SiO3,沉淀溶解的发生反应:Al(OH)3+3H+= Al3++3H2O。则形成沉淀的反应为:AlO2-+H++H2O = Al(OH)3。2H++SiO32-= H2SiO3↓。综上所述溶液中一定含有OH-、CO32-、AlO2-、SiO32-。故正确选项为C。
本题难度:一般
4、选择题 下列说法中正确的是
A.常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42-、NH4+能大量共存
B.常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存
C.一定温度下。l L 0.5 mol·L-1NH4C1溶液与2 L 0.25 mol·L-1NH4Cl溶液含NH4+物质的量相同
D.反应ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq)说明Ksp(ZnS)>Ksp(CuS)