微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (8分)某研究性学习小组为测定镁和铝的混合物中铝的质量分数,称取该混合物a g,溶于200 ml 5 mol/L HCl溶液中,共收集到标准状况下的氢气3.36 L。
(1)a的取值范围是__________________。
(2)向反应后所得溶液中逐渐加入4 mol/L的NaOH溶液。当沉淀质量达到最大值时,加入的NaOH溶液的体积是多少毫升?沉淀的最大质量为多少克?(用含a的代数式表示)。
(3)继续加入NaOH溶液至沉淀质量不再发生变化时,过滤、洗涤并灼烧沉淀至恒重,所得残余固体的质量仍为a g,计算原混合物中铝的质量分数。
参考答案:(8分)(1)2.7<a<3.6?(2)250? ,a+5.1?(3)40%
本题解析:(1)标准状况下3.36L气体的物质的量是3.36L÷22.4L/mol=0.15mol。根据反应的方程式2Al+6H+=2Al3++3H2↑、Mg+2H+=Mg2++H2↑可知,如果全部是铝生成的氢气,则铝的质量是0.1mol×27g/mol=2.7g。如果全部是镁生成的,则镁的质量是0.15mol×24g.mol=3.6g,所以a的取值范围是2.7<a<3.6。
(2)当沉淀质量达到最大值时,溶液中的溶质恰好是氯化钠,所以根据原子守恒可知,需要氢氧化钠的物质的量是0.2L×5mol/L=1mol,则需要氢氧化钠溶液的体积是1mol÷4mol/L=0.25L=250ml。镁或铝失去多少电子,相应的计算阳离子就结合多少OH-生成相应的氢氧化物沉淀。氢气是0.15mol,转移0.3mol电子。所以和金属阳离子结合的OH-的物质的量就是0.3mol,则沉淀的质量就是ag+0.3mol×17g/mol=(a+5.1)g。
(3)根据实验现象可知,过滤得到的白色沉淀是氢氧化镁,灼烧则生成氧化镁,这说明氧化镁的质量和原混合物的质量相等。由于镁原子的质量没有改变,因此原混合物中铝的质量分数就是氧化镁中氧元素的质量分数,即为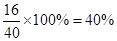 。
。
点评:该题的反应过程比较复杂,有关的化学方程式也比较多。该题的解题思路仍然是抛弃反应过程,根据最终的结果,充分利用各种解题技巧,抓住问题的关键,化繁为简。该题的难度较大,对学生的思维要求较高。既考查了学生的对基础知识的熟练程度,更重要的是考查学生灵活运用知识解决实际问题的解题能力。
本题难度:一般
2、选择题 设NA代表阿伏加德罗常数(NA)的数值,下列说法正确的是
A.1 mol硫酸钾中阴离子所带电荷数为NA
B.乙烯(C2H4)和环丙烷(C3H6)组成的28 g混合气体中含有2NA个氢原子
C.1mol Na2O2固体中含有NA个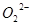
D.将含0.1 mol氯化铁的饱和溶液滴加到沸水中可制取0.1NA个 Fe(OH)3胶体微粒
参考答案:C
本题解析:考查阿伏加德罗常数的应用。1 mol硫酸钾中阴离子所带电荷数为2NA,选项A不正确;乙烯(C2H4)和环丙烷(C3H6)的最简式相同,都是CH2,所以28 g混合气体中含有4NA个氢原子,选项B不正确;氯化铁与水反应制取胶体的反应是可逆的,选项D不正确,答案选C。
本题难度:一般
3、选择题 将一定量的金属钠放入一定物质的量浓度的NaOH溶液中,反应完成后,NaOH溶液的物质的量浓度?(?)
A.增大
B.不能确定
C.减少
D.不变
参考答案:B
本题解析:选B
当原NaOH溶液是饱和溶液时,反应后浓度不变;当原NaOH溶液是不饱和溶液时,反应后浓度增大。
本题难度:简单
4、简答题 现要配制500mL、0.2mol?L-1的硫酸溶液
(1)需用质量分数为98%、密度为1.84g?cm-3的浓硫酸______mL.
(2)完成该实验需要的玻璃仪器主要有烧杯、量筒、______、______、______
(3)下列操作使所配溶液的物质的量浓度偏高的是______
A.往容量瓶中转移溶液时,有少量液体溅出.
B.未洗涤烧杯
C.定容时俯视刻度线
D.洗净容量瓶未干燥即用来配制溶液
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
参考答案:(1)浓硫酸的浓度C=1000ρwM=1000×1.84×98%98mol/L=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.2/L×0.5L,V=0.0054L=5.4mL,
故答案为:5.4;
(2)500mL容量瓶用来配制溶液,用玻璃棒引流液体,用胶头滴管定容,故答案为:500ml容量瓶、玻璃棒、胶头滴管;
(3)A.往容量瓶中转移溶液时,有少量液体溅出,溶质的物质的量偏小,配制溶液浓度偏低;
B.未洗涤烧杯,导致溶质的物质的量偏小,配制溶液浓度偏低;
C.定容时俯视刻度线,导致溶液体积偏小,配制溶液浓度偏高;
D.洗净容量瓶未干燥即用来配制溶液,对溶质的物质的量和溶液的体积都无影响,所以配制溶液浓度无影响;
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,溶液的体积偏大,配制溶液浓度偏低;
故选C.
本题解析:
本题难度:一般
5、填空题 配制0.25mol?L-1的NaOH溶液100mL,某学生操作如下:
①用托盘天平称出1.00g氢氧化钠:将天平调好零点,再在两盘上各取一张同样质量的纸,把游码调到1.00g的位置上,于左盘放粒状氢氧化钠至天平平衡,取下称好的氢氧化钠,并撤掉两盘上的纸.
②把称好的氢氧化钠放入一只100mL的烧杯中,加入约10mL水,搅拌使之溶解,溶解后立即用玻璃棒引流将溶液移至一只100mL的容量瓶内,加水至离刻度线约2cm处,用滴管加水至刻度线.
③写出一个标有配制日期的“0.25mol?L-1NaOH溶液”的标签,贴在容量瓶上密闭保存.指出上述操作中的7处错误:
(1)______;(2)______
(3)______;(4)______
(5)______;(6)______
(7)______.
参考答案:(1)由于氢氧化钠具有腐蚀性,称量时应放在干燥的烧杯中称量,
故答案为:NaOH应放在干燥的烧杯中称量;
(2)称量完氢氧化钠后,砝码放回砝码盒,游码拨回原处,
故答案为:用过的游码未拨回原处;
(3)由于托盘天平准确度为0.1g,不能称出1.00g氢氧化钠,
故答案为:托盘天平只能称出0.1g,称不出1.00 g;
(4)配制过程中,用于溶解的烧杯和玻璃棒必须进行洗涤,洗涤后的溶液应转入容量瓶中,
故答案为:烧杯和玻璃棒未洗涤,洗涤液亦应转入容量瓶;
(5)用于氢氧化钠溶解的过程中会放出热量,导致溶液的体积增大,所以必须冷却至室温后再转移的容量瓶中,
故答案为:溶解NaOH应冷却后再转移至容量瓶中;
(6)定容完毕,必须对配制的氢氧化钠溶液进行摇匀,
故答案为:容量瓶中的溶液未摇匀;
(7)容量瓶不能盛放溶液,配好的溶液应及时转移到有胶塞的试剂瓶内,
故答案为:配好的溶液应及时转移到有胶塞的试剂瓶内.
本题解析:
本题难度:一般