微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。若X原子的最外层电子数比其次外层电子数多3个,下列说法不正确的是
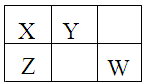
A.原子半径:Z>X>Y
B.最高价氧化物对应水化物的酸性:Z>W
C.W的单质是制取盐酸的原料之一
D.X、W的氢化物相遇会产生白烟
参考答案:B
本题解析:X原子的最外层电子数比其次外层 电子数多3个,说明X最外层为5个电子,是氮元素,所以Z为P元素,Y为O元素,W为Cl元素。A、根据元素周期律的原子半径的递变规律,电子层数越多半径越大,核电荷数越少半径越大,所以原子半径:Z>X>Y,正确;B、元素的非金属性W>Z,所以最高价氧化物对应水化物的酸性:Z<W,错误;C、氯气是制取盐酸的原料之一,正确;D、氨气与氯化氢相遇会产生白烟,正确,答案选B。
本题难度:一般
2、选择题 下图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等。下列叙述不正确的是
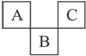
A.三种元素原子半径的大小顺序是:B<A<C
B.元素A最高价氧化物对应的水化物具有强酸性和强氧化性
C.B元素的氧化物、氢化物的水溶液都呈酸性
D.C元素的单质是非金属单质中唯一能跟水剧烈反应的单质
参考答案:A
本题解析:由题意知B的质量数为偶数,且B为第三周期元素,结合该图是周期表的一部分,所以B可能为硅或硫,若为硅,则AC分别为硼、氮元素,与三种元素原子核外电子数之和等于B的质量数不符,所以B为硫元素,则AC为氮、氟元素。A、三种元素原子半径的大小顺序是:B>A>C,错误;B、A为氮元素,其最高价氧化物对应的水化物硝酸具有强酸性和强氧化性,正确;C、硫元素的氧化物二氧化硫、三氧化硫、氢化物硫化氢的水溶液都呈酸性,正确;D、氟单质是非金属单质中唯一能跟水剧烈反应的单质,正确,答案选A。
本题难度:一般
3、填空题 为清理路面积雪人们使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是________,该物质中化学键类型是________,电子式是________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为________,电子式为________,化学键类型为________(填“离子键”“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成______,其化学键类型为________;加热时生成______,其化学键类型为________,电子式为________。
参考答案:(1)CaCl2 离子键 
(2)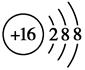 S=C=S
S=C=S 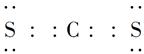 极性共价键
极性共价键
(3)Na2O 离子键 Na2O2 离子键和非极性共价键 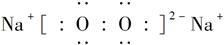
本题解析:(1)X的阳离子与Y的阴离子的电子层结构相同,且1 mol XY2中含54 mol电子,则每摩尔X、Y的离子含18 mol e-,可推出其化学式应为CaCl2,即X为Ca,Y为Cl。(2)D、E原子的最外层电子数是其电子层数的2倍,则其为He或C或S或Kr,又因D与Y相邻,则D为S,He、Kr与D不能形成分子,则E为C,C与S形成的分子为CS2。(3)W是与硫同主族的短周期元素,则W是氧;Z是第三周期金属性最强的元素,则Z是Na。Na在O2中反应不加热时生成Na2O,加热时生成Na2O2,Na2O2中Na+与O22-间形成离子键,O22-内部形成非极性共价键。
本题难度:一般
4、填空题 下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:

| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0
|
1
| A
| ?
|
2
| ?
| ?
| ?
| D
| E
| ?
| G
| ?
|
3
| B
| ?
| C
| J
| F
| ?
| H
| I
|
(1)表中元素,化学性质最不活泼的是?,可用于制半导体材料的元素是______。
(2)最高价氧化物的水化物酸性最强的是?。(填写最高价氧化物的水化物的化学式)
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的?。
(4)写出D的氧化物中能造成温室效应的电子式?。
参考答案:(1)Ar? Si? (2)HClO4? (3)HF? (4) 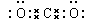
本题解析:考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的相对位置可知A、B、C、D、E、F、G、H、I、J分别为H、Na、Al、C、N、P、F、Cl、Ar、Si。
本题难度:简单
5、选择题 下列叙述中,甲金属一定比乙金属活泼性强的是:(?)
A.甲原子电子层数比乙原子的电子层数多
B.在甲乙两种金属和盐酸构成的原电池中,甲作正极,乙作负极
C.1mol 甲和乙分别与足量的盐酸反应,产生H2的量:甲>乙
D.常温时,甲能从水中置换出氢,而乙不能
参考答案:D
本题解析:如金属不位于同一主族,例如Na和Cu,不能根据电子层数的多少来判断金属的活泼性强弱,故A错误;在甲乙两种金属和盐酸构成的原电池中,甲作正极,乙作负极,说明乙活泼,故B错误;产生氢气的多少取决于金属失去电子数的多少,与金属的活泼性无关,故C错误;金属的活泼性越强,越易与水反应,所以常温时,甲能从水中置换出氢,而乙不能可以说明甲金属一定比乙金属活泼性强,故D为本题的答案。
点评:本题考查了金属活动性的比较,该考点是考点的常考考点,本题侧重对学生基础知识的考查,本题难度不大。
本题难度:一般