微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (4分)向含有a mol FeBr3的溶液中,加入x mol Na2S。
A.当2x=a时,离子方程式为____________。
B.当x=a时,离子方程式为____________。
参考答案:(4分)A.2Fe3++S2-===2Fe2++S? B.2Fe3++2S2-===Fe2++S+FeS
本题解析:略
本题难度:一般
2、选择题 下列热化学方程式或离子方程式中,正确的是( )
A.稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3?kJ?mol-1,稀醋酸与稀NaOH溶液反应生成1?mol水,放出的热量少于57.3?kJ
B.500℃、30?MPa下,将0.5?mol?N2和1.5?mol?H2置于密闭容器中充分反应生成NH3(g),放热19.3?kJ,其热化学方程式为:
N2(g)+3H2(g)?
2NH3(g)△H=-38.6?kJ?mol-1
C.氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓
D.氧化铝溶于NaOH溶液:Al2O3+2OH-═2AlO2-+H2O
参考答案:A、25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mo l因醋酸是弱酸,电离时需要吸热,所以反放出的热量少于57.3?kJ,故A正确;
B、0.5mol?N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,因反应为可逆反应,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g),放热不是38.6kJ,则热化学反应方程式中的反应热数值错误,故B错误;
C、一水合氨是弱电解质,氯化镁溶液与氨水反应:Mg2++2NH3?H2O═Mg(OH)2↓+2NH4+,故C错误;
D、氧化铝溶于NaOH溶液:Al2O3+2NaOH═2NaAlO2+H2O,离子方程式为:Al2O3+2OH-═2AlO2-+H2O,故D正确;
故选AD.
本题解析:
本题难度:简单
3、选择题 在Fe+2Fe3+=3Fe2+的离子反应中,Fe3+代表的化合物不可以是( )
①Fe(OH)3②FeCl3③Fe2(SO4)3④Fe(SCN)3.
A.①③④
B.①③
C.①④
D.①
参考答案:Fe+2Fe3+=3Fe2+的离子反应中,Fe3+代表②FeCl3、③Fe2(SO4)3均可,
但①④在离子反应中保留化学式,不能拆分,则Fe3+代表的化合物不可以是①④,
故选C.
本题解析:
本题难度:简单
4、实验题 (15分)废旧碱性锌锰干电池内部的黑色物质A主要含有MnO2、NH4Cl、ZnCl2,还有少量的FeCl2和炭粉,用A制备高纯MnCO3的流程图如下。
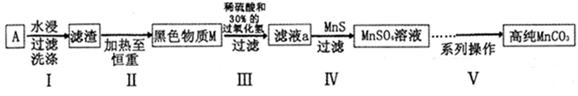
(1)碱性锌锰干电池的负极材料是?(填化学式)。
(2) 第I步操作得滤渣的成分是?;第Ⅱ步操作的目的是?。
(3)步骤Ⅲ中制得MnSO4,该反应的化学方程式为?。
(4)第Ⅳ步操作是对滤液a进行深度除杂,除去Zn2+的离子方程式为?。
(已知:Ksp(MnS)=2.5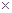 10-13,Ksp(ZnS)=1.6
10-13,Ksp(ZnS)=1.6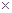 10-24)
10-24)
(5)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,l00oC时开始分解;Mn(OH)2开始沉淀时pH为7.7。
第V步系列操作可按以下步骤进行:
操作l:加入试剂X,控制pH<7.7;?操作2:过滤,用少量水洗涤2~3次;
操作3:检测滤液;?操作4:用少量无水乙醇洗涤2~3次;
操作5:低温烘干。
①试剂X是?;
②操作3中,说明SO42-已除干净的方法是?。
参考答案:(1)Zn。(2)MnO2和炭粉;除去炭粉。(3)MnO2+H2O2+H2SO4 MnSO4+2O2+H2O;
MnSO4+2O2+H2O;
(4)MnS+Zn2+ ZnS+Mn2+。(5)①Na2CO3;②取最后一次洗涤液少量置于试管中,加入硝酸钡,若无白色沉淀生成,说明SO42-已除干净。
ZnS+Mn2+。(5)①Na2CO3;②取最后一次洗涤液少量置于试管中,加入硝酸钡,若无白色沉淀生成,说明SO42-已除干净。
本题解析:根据题给信息和工艺流程知,黑色物质A主要含有MnO2、NH4Cl、ZnCl2,还有少量的FeCl2和炭粉,MnO2和炭粉不溶于水,经水浸、过滤、洗涤得滤渣的成分是MnO2和炭粉;MnO2和炭粉加热至恒重,碳粉与空气中的氧气反应生成碳的氧化物而除去,黑色物质M的主要成分为MnO2,MnO2与硫酸、双氧水反应生成硫酸锰、氧气和水,经过系列操作的高纯MnCO3。(1)根据教材知识知,碱性锌锰干电池的负极材料是Zn。(2) 由上述分析知,第I步操作得滤渣的成分是MnO2和炭粉;第Ⅱ步操作的目的是除去炭粉。(3)MnO2与硫酸、双氧水反应生成硫酸锰、氧气和水,该反应的化学方程式为MnO2+H2O2+H2SO4 MnSO4+2O2+H2O。(4)由Ksp(MnS)=2.5
MnSO4+2O2+H2O。(4)由Ksp(MnS)=2.5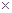 10-13,Ksp(ZnS)=1.6
10-13,Ksp(ZnS)=1.6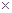 10-24知,ZnS比MnS更难溶,利用沉淀的转化除去Zn2+的离子方程式为MnS+Zn2+
10-24知,ZnS比MnS更难溶,利用沉淀的转化除去Zn2+的离子方程式为MnS+Zn2+ ZnS+Mn2+。 (5)第V步系列操作由硫酸锰制得高纯MnCO3。①试剂X是Na2CO3;②操作3为检验沉淀是否洗涤干净,说明SO42-已除干净的方法是取最后一次洗涤液少量置于试管中,加入硝酸钡,若无白色沉淀生成,说明SO42-已除干净。
ZnS+Mn2+。 (5)第V步系列操作由硫酸锰制得高纯MnCO3。①试剂X是Na2CO3;②操作3为检验沉淀是否洗涤干净,说明SO42-已除干净的方法是取最后一次洗涤液少量置于试管中,加入硝酸钡,若无白色沉淀生成,说明SO42-已除干净。
本题难度:一般
5、填空题 (8分)请写出下列反应的离子方程式
①少量二氧化碳通入澄清石灰水中?②氯化钠溶液与硝酸银溶液混合
③碳酸钙与稀硝酸反应?④氢氧化铁加入稀盐酸
参考答案:(8分)①CO2+Ca2++2OH-=CaCO3↓+H2O
②Ag++Cl-=AgCl↓
③CaCO3+2H+=Ca2++CO2↑+H2O
④Fe(OH)3+3H+=Fe3++3H2O
本题解析:考查常见离子方程式的书写。书写离子方程式关键是记住哪些物质用化学式表示,哪些物质用离子符号表示,只有同时满足易容易电离才能用离子表示,其余全部都用化学式表示。
本题难度:简单