微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式正确的是
[? ]
A、Cl2与NaOH溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
B、F2与NaOH溶液反应:F2+4OH-=2F-+O2+2H2O
C、AgNO3溶液中加入过量氨水:Ag++2NH3·H2O=Ag(NH3)2++2H2O
D、Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O
参考答案:AC
本题解析:
本题难度:简单
2、选择题 化学用语是学习化学的工具和基础。下列有关化学用语的使用正确的是
[? ]
A.用食醋除去水壶内的水垢:CaCO3+2H+?=?Ca2++CO2↑+H2O
B.纯碱溶液呈碱性的原因是:CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
C.?钢铁发生吸氧腐蚀的正极反应式:O2+?4e-?+2H2O?=4OH-
D.表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)=?2H2O(l);△H?=?-571.6?KJ·mol-1
参考答案:C
本题解析:
本题难度:一般
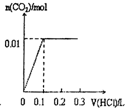
3、选择题 将0.56克KOH和1.38克K2CO3混合并配成溶液,向溶液中滴加0.1mol?L-1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.

B.
C.

D.

参考答案:0.56克KOH的物质的量为0.56g56g/mol=0.01mol,1.38克K2CO3的物质的量为1.38g138g/mol=0.01mol,KOH和K2CO3混合配成的溶液,当滴加盐酸时,先发生氢氧化钾与盐酸的中和反应,再发生碳酸钾与盐酸的反应生成碳酸氢钾和氯化钾,最后发生碳酸氢钾与盐酸反应才有二氧化碳气体生成,
A、加入0.1L盐酸,n(HCl)=0.1L×0.1mol/L=0.01mol,0.01mol盐酸与氢氧化钾反应没有气体生成,再加入0.01molHCl,与0.01mol碳酸钾恰好反应生成碳酸氢钾,也没有气体生成,则图象与实际不符,故A错误;
B、先发生氢氧化钾与盐酸的中和反应,图象中开始反应即有气体生成,与反应不符,故B错误;
C、向KOH和K2CO3混合溶液中滴加盐酸时,首先和KOH反应生成水和氯化钾,当滴入0.1L时,两者恰好反应完全;继续滴加时,盐酸和K2CO3开始反应,首先发生HCl+K2CO3=KHCO3+KCl,不放出气体,当再加入0.1L时,此步反应进行完全;继续滴加时,发生反应:KHCO3+HCl=KCl+H2O+CO2↑,此时开始放出气体,再消耗0.1L盐酸,生成二氧化碳达最大,图象与实际相符合,故C正确;
D、因碳酸钾与盐酸的反应分步完成,则碳酸钾与盐酸先反应生成碳酸氢钾和氯化钾,此时没有气体生成,则图象与反应不符,故D错误;
故选C.
本题解析:
本题难度:一般
4、选择题 有一个未完成的离子方程式?+XO3-+6H+=3X2+3H2O。据此判断下列说法中正确的是
A.X可能是周期表中第二周期元素
B.X元素的原子最外层上有7个电子
C.X2是还原产物,H2O是氧化产物
D.若生成3 mol X2,转移6 mol电子
参考答案:B
本题解析:根据配平原则,该方程式中缺少的是5X-,X的最低价是-1价,其最高价是+7,最外层有7个电子,所以X不可能在第二周期,即F元素;X2即是氧化产物又是还原产物;若生成3molX2,电子转移5mol。
本题难度:一般
5、选择题 下列离子方程式正确的是(?)
A.澄清石灰水中滴加稀硫酸:Ca(OH)2+2H+====Ca2++2H2O
B.实验室用氨水制备少量Al(OH)3:Al3++ 3OH-====Al(OH)3↓
C.向FeBr2溶液中通入过量氯气:2Fe2++Cl2====2Fe3++2Cl-
D.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:
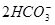 +2OH-====CaCO3↓+
+2OH-====CaCO3↓+ +2H2O
+2H2O