微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列数据是对应物质的熔点(单位:℃)?
Na2O
| NaCl
| AlF3
| AlCl3
| BCl3
| Al2O3
| CO2
| SiO2
|
920
| 801
| 1291
| 190
| -107
| 2073
| -57
| 1723
|
据此做出的下列判断中,正确的是 (? )
A、铝的化合物晶体类型完全相同
B、原子晶体的熔点一定比离子晶体高
C、同族元素的氧化物一定形成相同类型的晶体
D、不同族元素的氧化物可形成相同类型的晶体
参考答案:D
本题解析:A不正确,氯化铝是分子晶体,氧化铝是离子晶体。B不正确,例如二氧化硅的熔点低于氧化铝的。C不正确,例如CO2是分子晶体,二氧化硅是原子晶体。答案选D。
本题难度:一般
2、选择题 下列判断正确的是
A.含有共价键的化合物一定是共价化合物
B.晶体中一定存在化学键
C.含有离子键的化合物一定是离子化合物
D.金属键越强,金属越活泼,金属熔点越高
参考答案:C
本题解析:A 错误,含有共价键的化合物不一定是共价化合物,例如:过氧化钠
B 错误,晶体中不一定存在化学键,例如:稀有气体
C 正确。
D 错误,金属键越强,金属越活泼,金属熔点越低。
本题难度:一般
3、填空题 (11分)T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
元素
| 相关信息
|
T
| T原子所处的周期数、族序数分别与其原子序数相等
|
X
| X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同
|
Z
| Z的基态原子价电子排布为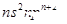
|
Q
| 在该元素所在周期中,Q的基态原子的第一电离能最小
|
R
| 3p能级上有1个电子
|
W
| W的一种核素的质量数为65,中子数为36
|
(1)X、Y、Q三种元素的电负性由大到小的顺序是?(用元素符号表示)。
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要?(填“高”、“低”)。
(3)W2+的核外电子排布式为?。元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示错误的是?
A.氧化剂是O2? B.HO2在碱中不能稳定存在
C.氧化产物是HO2? D.1 molW参加反应有1 mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子。其中A、B、C均为10电子微粒,D为18电子微粒。A为5原子核的+1价阳离子,则A+的中心原子杂化方式为_______. B为4原子核的+1价阳离子,则B+电子式为___________。C为4个原子核构成的分子,则与C互为等电子体的分子可以是_______(写结构式)。D分子中两元素的原子个数之比为1:1,则D为?(填“极性”或“非极性”)分子。某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为______________________。
(5)已知25℃、101 kPa条件下:
4R(s)+3Z2(g)?2R2Z3(s)?△H=-2835.9 kJ/mol
4R(s)+2Z3(g)?2R2Z3(s)?△H=-3119.1 kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H=?.
参考答案:1)N>C>Na?(2)高?(3)[Ar]3d9或1s22s22p63s23p63d9;C
(4)sp3?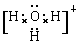 ?
? ,?极性? 2F2+2H2O=4HF+O2
,?极性? 2F2+2H2O=4HF+O2
(5)+47.2 kJ/mol(2分)
本题解析:根据元素的结构及其性质可知,T、X、Y、Z、Q、R、W分别是H、C、N、O、Na、Al、Cu。
(1)非金属性越强,电负性越大,所以X、Y、Q三种元素的电负性由大到小的顺序是N>C>Na。
(2),晶体结构与金刚石类似,石墨是原子晶体。由于碳原子半径大于氮原子半径,原子半径越小,共价键越强,所以该晶体的熔点大于金刚石的。
(3)根据构造原理可知,铜离子的电子排布式为[Ar]3d9或1s22s22p63s23p63d9。根据方程式可知,氧气是氧化剂,所以HO2是还原产物,选项C不正确,其余都是正确的,答案选C。
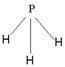
(4)A为5原子核的+1价阳离子,则A是NH4+,氮原子是sp3杂化。B为4原子核的+1价阳离子,则B是H3O+,其电子式为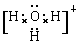 。C为4个原子核构成的分子,则C是氨气,所以与氨气互为等电子体的分子可以是PH3,其结构式为
。C为4个原子核构成的分子,则C是氨气,所以与氨气互为等电子体的分子可以是PH3,其结构式为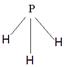 。D是双氧水,属于极性分子。E应该是是单质氟,和水反应的方程式为2F2+2H2O=4HF+O2。
。D是双氧水,属于极性分子。E应该是是单质氟,和水反应的方程式为2F2+2H2O=4HF+O2。
(5)考查盖斯定律的应用。①-②即得到3Z2(g)?2Z3(g)?△H=+283.2 kJ/mol。所以16g Z2(g)完全转化为Z3(g)的△H=+283.2 kJ/mol÷6=+47.2 kJ/mol。
本题难度:一般
4、选择题 纳米材料是21世纪最有前途的新型材料之一,世界各国对这一新材料给予了极大的关注。纳米粒子是指直径为1~100 nm的超细粒子(1 nm=10-9 m)。由于表面效应和体积效应,其常有奇特的光、电、磁、热等性能,可开发为新型功能材料,有关纳米粒子的叙述不正确的是(?)。
A.因纳米粒子半径太小,故不能将其制成胶体
B.一定条件下纳米粒子可催化水的分解
C.一定条件下,纳米陶瓷可发生任意弯曲,可塑性好
D.纳米粒子半径小,表面活性高
参考答案:A
本题解析:题中涉及纳米材料这一新型材料,根据纳米粒子微粒大小,判断出其分散质粒子大小刚好处在胶体分散质大小的范围内,因此我们要结合胶体知识,并紧密联系题干中的有关知识分析、讨论。
本题难度:一般
5、选择题 下列关于晶体与非晶体的说法中正确的是
[? ]
A.固体SiO2一定是晶体
B.晶体有自范性但排列杂乱无章
C.非晶体无自范性而且排列无序
D.非晶体一定比晶体的熔点高
参考答案:C
本题解析:
本题难度:简单