微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 短周期主族元素X、Y、Z、W、Q的原子序数依次增大.X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z、W是常见金属,Z的氧化物可做耐火材料,W的简单离子是同周期中离子半径最小的,Q的p能级上有一个未成对电子.试回答下列问题:
(1)比较第一电离能:Z______W(填“>”、“<”或“=”,后同);电负性:X______Y.
(2)写出Q的价电子排布图______,YF3的结构式______.
(3)向硫酸铜溶液中逐滴滴入Y的氢化物的水溶液至过量,用离子方程式表示该过程出现的现象变化:______.
参考答案:短周期主族元素X、Y、Z、W、Q的原子序数依次增大.X原子核外最外层电子数是次外层的2倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素;Z、W是常见金属,原子序数大于碳元素,常用第三周期,Z的氧化物可做耐火材料,W的简单离子是同周期中离子半径最小的,则W为Al元素、Z为Mg元素;Y的氟化物YF3分子中各原子均达到8电子稳定结构,Y为非金属性,则Y表现+3价,最外层电子数为8-3=5,处于ⅤA族,原子序数小于Mg元素,则Y为氮元素;Q处于第三周期,p能级上有一个未成对电子,外围电子排布为3s23p1或3s23p5,由于W为Al元素,则Q为Cl元素,
(1)Mg原子2s能级容纳2个电子,为全满稳定状态,能量较低,第一电离能比Al元素的高;
同周期自左而右电负性增大,故电负性C<N,
故答案为:>;<;
(2)Q为Cl元素,外围电子排布为3s23p5,价电子排布图为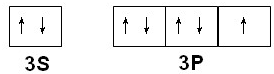 ,NF3中氮原子越氟原子之间形成1对共用电子对,结构式为:
,NF3中氮原子越氟原子之间形成1对共用电子对,结构式为: ,
,
故答案为: ;
; ;
;
(3)向硫酸铜溶液中逐滴滴入氨水溶液至过量,先生成氢氧化铜与硫酸铵,有蓝色沉淀生成,继续滴加过量的氨水,氢氧化铜与氨水反应生成四氨合铜络离子,蓝色沉淀消失,溶液呈深蓝色,反应离子方程式为:Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+;或Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+;或Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O.
本题解析:
本题难度:一般
2、填空题 以下物质①HF②H2③H2O④N2⑤C2H4⑥H2O2⑦NaCl(填序号)
(1)只含有极性键的是_______________;
(2)既含有极性键又含有非极性键的是_______________;
(3)属于极性分子的是_______________;
(4)既有σ键又有π键的是_______________;
(5)含有s-sσ键的是_______________;
(6)以上物质为固体时,属于离子晶体的是_______________。
参考答案:(1)①③
(2)⑤⑥
(3)①③⑥
(4)④⑤
(5)②
(6)⑦
本题解析:
本题难度:一般
3、填空题 (每空2分?共16分)?20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;Ⅲ、分子中价层电子对之间的斥力主要顺序为:? i、孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力;? ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;? iii、X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;? iv、其他。
请仔细阅读上述材料,回答下列问题:
(1)根据要点I可以画出AXnEm的VSEPR理想模型,请填写下表:
n+m
| 2
| ?
|
VSEPR理想模型
| ?
| 正四面体
|
价层电子对之间的理想键角
| ?
| 109°28′
|
(2)请用VSEPR模型解释CO2为直线型分子的原因?。
(3) H2O分子的立体构型为:?,请你预测水分子中∠H-O-H的大小范围为?,原因是?。
(4) SO2Cl2和SO2F2都属AX4E0型分子,S=O之间以双键结合,S-Cl、S-F之间以单键结合。请你预测 SO2Cl2和SO2F2分子的立体构型:?。
参考答案:(每空1分,共16分)
(1)
?
4
直线形
?
180°
?
? (2) CO2属AX2E0,n+m=2,故为直线形
(3)? V形?∠H-O-H<109°28′?水分子属AX2E2,n+m=4,VSEPR理想模型为正四面体,价层电子对之间的夹角均为109°28′。根据Ⅲ-i,应有∠H-O-H<109°28′
(4) 四面体
本题解析:(1)如果价层电子对数为2,则n只能是2,m只能是0,所以是直线型结构,其键角是180°。如果分子是正四面体结构,键角是109°28′,则价层电子对数一定是4。
(2)CO2分子中中心原子含有的孤对电子对数是(4-2×2)÷2=0,即不含有孤对电子,CO2属AX2E0,n+m=2,所以CO2分子是直线型结构。
(3)H2O分子中中心原子含有的孤对电子对数是(6-1×2)÷2=2,即水分子是V形结构。由于水分子属AX2E2,n+m=4,VSEPR理想模型为正四面体,价层电子对之间的夹角均为109°28′。根据Ⅲ-i可知,应有∠H-O-H<109°28′。
(4)由于SO2Cl2和SO2F2都属AX4E0型分子,所以n+m=4。又因为双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;所以二者都是四面体形结构,而不是正四面体结构。
本题难度:一般
4、选择题 下列各组元素中,已知A、B两种元素的原子序数,其中可组成AB3型离子化合物的是(?)
A.6和9?B.13和17?C.11和8?D.12和17
参考答案:B
本题解析:用列举法,把常见的AB3型化合物都列举出来,再从中选出属于离子化合物的,与选项进行一一对照。或用代入法,把四个选项中每对原子序数所能组成的化合物写出,再与题干对照,看是否满足题意。或用排除法,观察到AB3这种组成方式中A、B的价态应是同为奇数或同为偶数,所以原子序数的奇偶性也应一致,所以可直接排除A、C、D三项。
本题难度:简单
5、填空题 卤素性质活泼,能形成卤化物、多卤化物等多种类型的化合物。
(1)卤化氢中,HF的沸点高于HCl,原因是____________________________
____________________________________________。
(2)如图为F-与Mg2+、K+形成的某种离子晶体的晶胞,其中“○”表示的离子是________(填离子符号)。

(3)多卤化物Rb[ICl2]分解时生成晶格能相对较大的铷(Rb)的卤化物,则该卤化物的化学式为_______________。
(4)BF3与NH3能发生反应生成X(H3BNF3),X的结构式为____________(用“→”表示出配位键):X中B原子的杂化方式为____________________________。
(5)有一类物质的性质与卤素类似,称为“拟卤素”[如(SCN)2、(CN)2等]。(CN)2的结构式为CNCN,该分子中σ键和π键数目之比为________。
参考答案:(1)HF分子间形成氢键 (2)F- (3)RbCl
(4)  sp3杂化 (5)3∶4
sp3杂化 (5)3∶4
本题解析:(1)HF、HCl均为分子晶体,其中HF能形成分子间氢键,使沸点升高。(2)由晶胞结构可知,黑球有1个,灰球有1个,白球有3个,由电荷守恒可知离子数关系为N(Mg2+)∶N(K+)∶N(F-)=1∶1∶3,得白球为F-。(3)分解时可形成RbI或RbCl两种卤化物,由于r(Cl-)<r(I-),所以后者晶格能大。(4)注意B为ⅢA族元素,最外层只有3个电子,有1个空轨道,N为VA族元素,有一对孤对电子,写出结构式。B原子形成4根键,即0+4=4,sp3杂化。(5)叁键中有1个σ键、2个π键,单键均为σ键。
本题难度:一般