微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 已知A~I有如图所示转换关系
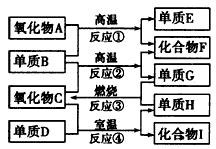
已知:①单质E可作为半导体材料;②化合物F是不成盐的氧化物;③化合物I溶于水呈酸性,它能够跟氧化物A起反应。据此,请填空:
(1)化合物F是_____________。
(2)化合物I是_____________。
(3)反应③的化学方程式是____________________。
(4)反应④的化学方程式是____________________。
(5)写出I的水溶液与A反应的方程式:_______________________。
参考答案:(1)CO
(2)HF
(3)2H2+O2=2H2O
(4)2F2+2H2O=4HF+O2
(5)4HF+SiO2=SiF4↑+2H2O
本题解析:
本题难度:一般
2、推断题 在下列各变化中,E为常温下无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。?
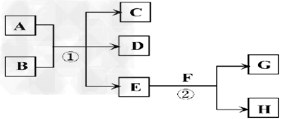
回答下列问题:
(1)写出H的电子式:_________________
(2)若反应①在加热条件下进行,A为单质,C为无色有刺激性气味的气体,D为无色无味的气体,且C、D两种气体均能使澄清的石灰水变浑浊,则反应①的化学方程式是_______________。
①实验需要检验出C、D、E三种气体产物,三种气体检验的先后顺序是____________(用化学式填空),在检验D气体前,需除去C气体,所用试剂是___________,反应的离子方程式是?__________________。
②已知:
A(s)+O2(g)?=AO2(g)?△H=-393.5kJ·mol-1?
2A(s)+O2(g)?=2AO(g)?△H=-221.0kJ·mol-1
则AO的燃烧热的热化学方程式___________________________________.
③AO2在自然界循环时可与碳酸钙反应,碳酸钙是一种难溶物质,它的Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为__________。
(3)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,且B遇盐酸产生能使品红溶液褪色的气体,在加热条件下,当A过量时,反应①的离子方程式是_______________。
(4)若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素组成,当A过量时,C及D均易溶于水,则A过量时反应①的离子方程式是______________。
参考答案:(1)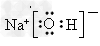
(2)C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O
①H2O、SO2、CO2? ;酸性KMnO4溶液 ;?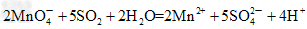
②CO(g)+?1/2?O2(g)=CO2(g)?△H=-283.0kJ·mol-1?
③5.6×10-5mol/L
(3)2OH-+NH4+?+HSO3-?=NH3↑+2H2O+SO32-?
(4)4H++AlO2-?=Al3++2H2O
本题解析:
本题难度:一般
3、推断题 图中所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B 与气体C相遇产生大量的白烟,D是海水中浓度最高的盐(部分反应物和生成物及溶剂水已略去)。
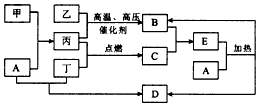
请回答下列问题:
(1)甲的化学式是______________,C的化学式为__________________________。
(2)写出A溶液和丁反应生成D的离子方程式:_____________________________。
(3)写出A和E反应的化学方程式:____________________________。
参考答案:(1)Al;HCl
(2)2OH-+Cl2 = Cl-+ClO-+H2O
(3)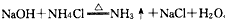
本题解析:
本题难度:一般
4、简答题 已知X+、Y3+、Z-、W2-是短周期元素X、Y、Z、W形成的离子,甲、乙、丙均是由上述四种离子中的两种组成的化合物.甲、乙、丙溶于水所得溶液分别呈酸性、碱性和中性.
(1)通常状况下,Z的单质是一种黄绿色气体,工业上常用电解丙的溶液的方法制备该单质,制备反应的化学方程式是______;
(2)甲的化学式是______,乙的化学式可能是______;若将甲的溶液与乙的溶液混合产生沉淀和气体,则反应的离子方程式是______;
(3)Y单质可用来制造Y-空气燃料电池,该电池通常以氢氧化钾溶液为电解质溶液,则正极反应式为______.
参考答案:X+、Y3+、Z-、W2-是短周期元素X、Y、Z、W形成的离子,甲、乙、丙均是由上述四种离子中的两种组成的化合物.甲、乙、丙溶于水所得溶液分别呈酸性、碱性和中性.依据题意Z的单质是一种黄绿色气体,说明Z为Cl2;丙为氯化钠,判断X为Na,得到中性溶液丙的为NaCl,酸性溶液甲是Y3+水解,所以甲溶液为AlCl3,Y为铝元素;碱性溶液是阴离子水解的原因,所以乙为Na2S或Na2O,则推断出的元素为:X、Na;Y、Al;Z、Cl;W、S或O;甲为AlCl3;乙为Na2S或Na2O;丙为NaCl;
(1)工业上常用电解氯化钠的溶液的方法制备该单质,制备反应的化学方程式:2NaCl+2H2O?通电?.?2NaOH+H2↑+Cl2↑;故答案为:2NaCl+2H2O?通电?.?2NaOH+H2↑+Cl2↑;
(2)甲的化学式为:AlCl3 ;?乙化学式为:Na2S或Na2O;甲的溶液与乙的溶液混合产生沉淀和气体则一定是氯化铝和硫化钠发生双水解反应,反应的离子方程式为:2Al3++3S2-+6H2O═2Al(OH)3↓+3H2S↑;故答案为:AlCl3;Na2S或Na2O;2Al3++3S2-+6H2O═2Al(OH)3↓+3H2S↑;
(3)Y为Al单质可用来制造Al-空气燃料电池,该电池通常以氢氧化钾溶液为电解质溶液,负极是铝失电子发生氧化反应,正极是氧气得到电子发生还原反应,反应式:O2+2H2O+4e-→4OH-
故答案为:O2+2H2O+4e-→4OH-
本题解析:
本题难度:一般
5、推断题 已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G?为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。其转化关系如图。
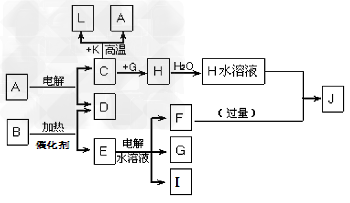
请回答:
(1)工业上制C用A不用H的原因_________________
(2)写出C与K反应的化学方程式?____________,该反应的反应物总能量__________(填“大于”或“小于”)生成物总能量
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式______________________,电解后为使溶液与电解前完全相同,需向上述溶液中通入______________
(4)J与H反应的离子方程式为___________________,若在上述转化关系中每一步反应均为恰好反应,且不考虑C+K→A+L的变化时,为了最终得到J,则A、B的物质的量之比为?
____________?
参考答案:(1)氯化铝是共价化合物,熔融不导电,氧化铝是离子化合物(合理即可)
(2)2Al+Fe2O3 Al2O3+2Fe;大于
Al2O3+2Fe;大于
(3)2KCl+2H2O 2KOH+H2↑+Cl2↑;氯化氢或HCl
2KOH+H2↑+Cl2↑;氯化氢或HCl
(4)Al3++3AlO2-+6H2O=4Al(OH)3↓;1∶8
本题解析:
本题难度:一般