微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 物质A、B、C、D、E、F、G、H、I、J、K有下图转化关系,其中气体D、E为单质,

请按要求回答下列问题。
⑴组成金属A的元素在周期表的位置是_____________,
D的化学式是__________________
⑵写出反应“C→F”的离子方程式?;
⑶写出反应“ I→J”的离子方程式?;
⑷写出金属 H与水蒸气在高温下反应的化学方程式?。
参考答案:(1)第三周期ⅢA族、 HCl
(2)Al3++3NH3·H2O=Al(OH)3+3NH4+
(3)2Fe2++Cl2=2Fe3++2Cl-
(4)3Fe+4H2O=Fe3O4+4H2
本题解析:本题无机框图题,关键是找准突破点。红褐色沉淀K,所以K是氢氧化铁。黄绿色气体E,说明E是氯气,则B是氯化氢,H是铁,I是氯化亚铁,J是氯化铁。A是铝,C是氯化铝,F是氢氧化铝,G是偏铝酸钠。
本题难度:一般
2、推断题 现有金属单质A.B.C和气体甲、乙、丙及物质D.E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
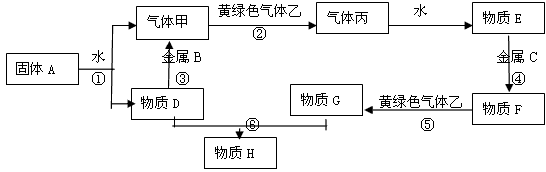
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
A? ?、 B? 、 C? ?、 F? 、 H? 、 乙? ?
(2)写出下列反应化学方程式:
反应①? ?
反应⑤? ? ?
反应⑥? ?
参考答案:(1)A:Na? B:Al? C:Fe? F:FeCl2? H:Fe(OH)3? 乙:Cl2
(2)反应①:2Na + 2H2O == 2NaOH + H2↑
反应⑤:2FeCl2 + Cl2 == 2FeCl3
反应⑥:FeCl3+ 3NaOH == Fe(OH)3↓+ 3NaCl
本题解析:
本题难度:一般
3、推断题 A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示(部分产物略去)。
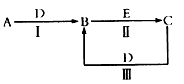
(1)若A是能使湿润红色石蕊试纸变蓝的气体;C、D均为空气的主要成分;E是一种有毒气体。
①C的电子式为________;
②写出反应I的化学方程式________________;
③写出反应Ⅱ的化学方程式____________________。
(2)若A是淡黄色化合物;常温下D是无色气体;C中含有的阴、阳离子均为10电子粒子。
①D的结构式为___________,C中所含化学键的类型是___________
②写出反应I的化学方程式___________________;
③写出反应Ⅱ的化学方程式___________________。
(3)将(2)中一定量的气体D 通入2LC的溶液中,逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl 物质的量的关系如下图所示(忽略气体的溶解和HCl 的挥发)。
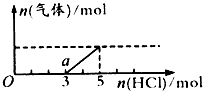
①O点溶液中所含溶质的化学式为____,常温下a点溶液的pH____(填“>”“=”或“<”)7,a点溶液中各离子浓度由大到小的关系是____________;
②标准状况下,通入气体D的体积为____L,C溶液的物质的量浓度为____ mol/L。
参考答案:(1)①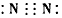 ;②4NH3+5O2
;②4NH3+5O2 4NO+6H2O;③2NO+2CO
4NO+6H2O;③2NO+2CO N2+ 2CO2
N2+ 2CO2
(2) ①O=C=O;(极性)共价键、离子键;②Na2O2 +2CO2 =2Na2CO3+O2;③Ca(OH)2+ Na2CO3=
CaCO3↓+2NaOH
(3)①NaOH、Na2CO3;>;c(Na+) >c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);②44.8;2.5
本题解析:
本题难度:困难
4、填空题 A、B、C、X均为中学化学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
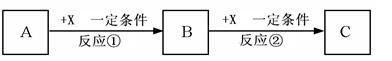
试回答:
(1)若X是强氧化性单质,则A不可能是?(填字母)。
a.S? b.N2? c.Na? d.Mg? e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为?;在贮存C溶液时应加入少量X,理由是?(用必要的文字和离子方程式表示)。
(3)若A、B、C为含有金属元素的无机化合物,X为强酸或强碱,A溶液与C溶液反应生成B。反应①的离子方程式可能为?或?。
参考答案:(1)de(2分,选对1个得1分,有错不得分)
(2)FeCl3(1分)2Fe3++Fe=3Fe2+,防止Fe2+被氧化(2分)
(3)Al3++3OH-=Al(OH)3↓(2分)[Al(OH)4]-+H+=Al(OH)3↓+H2O(2分)
本题解析:(1)若X是氧气时,A分别是a.Sb.N2c.Na?都能满足,故选de。(2)若X是金属单质,A可以为铁,B为氯化铁,C为氯化亚铁。由于亚铁离子易被空气氧化所以加入铁粉发生反应为2Fe3++Fe=3Fe2+,这样可以防止Fe2+被氧化。(3)根据题干信息,A溶液与C溶液反应生成B。可知两者分别是铝离子和偏铝酸根离子的盐溶液,故发生的离子反应为Al3++3OH-=Al(OH)3↓和[Al(OH)4]-+H+=Al(OH)3↓+H2O。
本题难度:一般
5、填空题 (10分)已知A是治疗胃酸过多症的一种药剂,B是一种淡黄色固体,A、B以物质的量之比1∶1混合加热生成C、D、E三种物质,E、F、J是常见的气体单质,有如下转化关系:
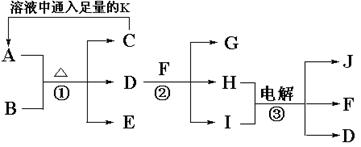
(1)写出A与D反应的离子方程式_________________________________________;
(2)写出反应②的化学方程式? __________________________________________。
(3)电解③时阳极产生气体168mL(标准状况),电解后溶液的体积为150mL,此时溶液的pH为________________。
(4)将等物质的量的A和C溶于100mL水中,下列溶液说法不正确的是_________。
A.2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3)
B.c(Na+)+ c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
C.c(CO32-)+2c(OH-)= 3c(H2CO3) + c(HCO3-) + 2c(H+)
D.c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+)
(5)若A、B混合后加热得到纯净物,反应的方程式为_________________________
参考答案:(1) HCO3-+OH-=CO32-+H2O
(2) 2NaOH+Cl2=NaCl+NaClO+H2O
(3) 13?
(4) D
(5)4NaHCO3+2Na2O2=4Na2CO3+O2↑+2H2O↑
本题解析:根据题干信息和物质转换图可推断出:A为NaHCO3,B为Na2O2,C为Na2CO3,D为NaOH,E为O2,F为Cl2,G为NaClO,H为NaCl,I为H2O,J为H2,K为CO2
(1)故A与D反应的离子方程式为 HCO3-+OH-=CO32-+H2O
(2)Cl2和NaOH反应生成NaCl、NaClO和H2O,注意配平
(3)总反应为2NaCl+2H2O=2NaOH+H2+Cl2,生成168mlCl2(0.0075mol)时,生成0.015molNaOH,又体积为0.15L,故C(OH-)=0.1mol/L,所以PH为13
(4)A、C为物料守恒,正确;B为电荷守恒,正确;D项应该 c(CO32-)<c(HCO3-)
(5)4NaHCO3+2Na2O2=4Na2CO3+O2↑+2H2O↑
点评:框图推断题是化学中常见的一类题型。推断题要抓住题干或者相互转化关系图中的题眼,便可迎刃而解,该题综合性强,难度较大。
本题难度:一般