微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
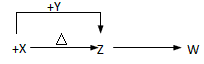
(1)W的电子式是____________ 。
(2)X与Y在溶液中反应的离子方程式是_______________ 。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置V中可收集到一种无色气体。
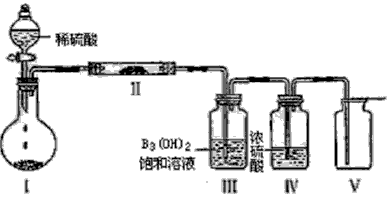
①装置I中反应的化学方程式是_________ , 装置II中物质的化学式是 ____________。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置V中气体,该化合物的化学式是________ ,所需仪器装置是_________ (从上图选择必要装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是 ______________。
参考答案:(1)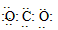
(2)HCO3-+OH-==CO32-+H2O
(3)①Na2CO3+H2SO4==Na2SO4+CO2↑+H2O 或2NaHCO3+H2SO4==Na2SO4+2CO2↑+2H2O ;Na2O2
②H2O2? ;I、IV、V
(4)2Na2CO3+Cl2+H2O==NaClO+NaCl+2NaHCO3
本题解析:
本题难度:一般
2、填空题 已知A、B、C、D、E、F?六种物质的转化关系如下:
①A+B→C+H2O
②C+KOH→D↓(蓝色)+E
③B+D→C+H2O
④E+BaCl2→KCl+F↓(白色,不溶于稀硝酸)
⑤G+B→CO2↑+F↓+H2O,反应中B与CO2的物质的量之比为1:2
根据上述变化关系填空:
(1)请写出下列物质的化学式:B______;C______;G______.
(2)检验E中阴离子的实验方法是______
(3)往G的溶液中滴加过量的KOH,反应的离子方程式为______.
参考答案:由②C+KOH→D↓(蓝色)+E,蓝色沉淀是氢氧化铜的特征颜色,证明C中含有铜离子,D为Cu(OH)2;④E+BaCl2→KCl+F↓(白色,不溶于稀硝酸)判断F为BaSO4沉淀,证明E中含有硫酸根离子,结合反应②可知E为K2SO4,C为CuSO4;③B+D→C+H2O,由反应可知,C为CuSO4,D为Cu(OH)2,判断B为H2SO4;反应①分析产物①A+B→C+H2O可知,A为CuO;
⑤G+B(H2SO4)→CO2↑+F(BaSO4)↓+H2O,反应中B与CO2的物质的量之比为1:2,推断G为Ba(HCO3)2;
(1)根据推断得到,B为H2SO4,C为CuSO4,G为Ba(HCO3)2,故答案为:H2SO4;CuSO4;Ba(HCO3)2;
(2)检验E(K2SO4)中阴离子为SO42-的实验方法是:先加足量的稀盐酸,再加氯化钡溶液,若有白色沉淀生成,则含有SO42-,
故答案为:先加足量的稀盐酸,再加氯化钡溶液,若有白色沉淀生成,则含有SO42-;
(3)往G为Ba(HCO3)2的溶液中滴加过量的KOH,反应是酸式盐和碱的反应,量少的全部反应,离子方程式中符合化学式的组成比,
反应的离子方程式为Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O,故答案为:Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O.
本题解析:
本题难度:一般
3、推断题 已知:A、B为短周期非金属单质且均为气体;甲、乙为短周期金属单质,乙在I的浓溶液中发生钝化;C、H、J的溶液均呈碱性.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件)

(1)写出A的电子式__________、C分子的空间构型:_____________。
(2)写出反应②的化学方程式____________________________。
(3)反应④的化学方程式为______________________________。
(4)反应⑤的化学方程式是______________________________。
(5)反应⑥的离子方程式是______________________________。
参考答案:(1)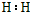 ;三角锥形
;三角锥形
(2)4NH3+5O2 4NO+6H2O
4NO+6H2O
(3)3NO2+H2O==2HNO3+NO
(4)2Na+2H2O==2NaOH+H2↑
(5)2Al+2H2O+2OH-==2AlO2-+3H2↑
本题解析:
本题难度:困难
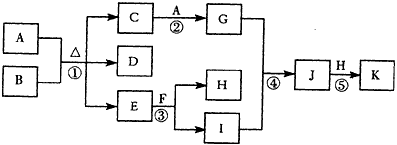
4、推断题 下图为一些常见物质的转化关系图(部分反应物与生成物未标出)。A、H为单质,其中H为气体;B、E为无色液体,F为淡黄色固体,K为红褐色固体;D的大量排放是形成酸雨的重要原因。
回答下列问题
(1)在常温下,A和B发生的变化称为___________。
(2)列举F的一种用途______________________
(3)反应⑤化学方程式是______________________
(4)常用于检验C中阳离子的物质是___________
(5)C溶液中通入D,也能实现C→G的转化,则该反应的离子方程式是_________________________。
参考答案:(1)钝化
(2)呼吸面具或潜水艇氧气的来源
(3)4Fe(OH)2+O2+2H2O==4Fe(OH)3
(4)硫氰化钾
(5)SO2+2Fe3++2H+==2Fe2++4H++SO42-
本题解析:
本题难度:一般
5、填空题 如图所涉及的物质均为中学化学中的常见物质,其中C、D为气体单质,E是目前人类应用最广泛的金属,其余为化合物.它们存在如图转化关系,反应中生成的水及次要产物均已略去.
(1)写出化学式:B______,G______.
(2)指出MnO2在相关反应中的作用:
反应①中是______剂,反应②中是______剂.
(3)完成F与B?发生反应的化学方程式______
(4)若反应①是在加热条件下进行,A是______;
若反应①是在常温条件下进行,A是______.
若在上述两种条件下得到等量的C单质,反应中转移的电子数之比为______.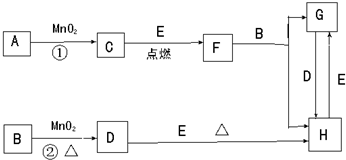
参考答案:与MnO2反应的制备的气体有O2和Cl2,其中在不加热条件下,用H2O2和MnO2制备O2,在加热条件下用浓盐酸和MnO2制备
Cl2,则A为H2O2,B为HCl,C为O2,D为Cl2,F为金属氧化物,与盐酸反应生成两种氯化物,且二者之间可以相互转化,说明E为变价金属,应为Fe,是目前人类应用最广泛的金属,则F为Fe3O4,G为FeCl2,H为FeCl3,则
(1)由以上分析可知,B为HCl,G为FeCl2,故答案为:HCl;FeCl2;
(2)在不加热条件下,用H2O2和MnO2制备O2,H2O2起到催化剂的作用,在加热条件下用浓盐酸和MnO2制备Cl2,发生:
4HCl(浓)+MnO2?△?.?MnCl2+Cl2↑+2H2O,MnO2起到氧化剂的作用,
故答案为:催化;氧化;
(3)Fe3O4中含有+2价和+3价Fe与盐酸反应生成FeCl3和FeCl2,反应的化学方程式为Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,
故答案为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;
(4)根据化合价变化判断,已知:2KClO3?MnO2?.△2KCl+3O2↑,生成3mol转移12mol电子,2H2O2?MnO2?.?2H2O+O2↑,生成3mol转移6mol电子,生成等物质的量的O2,反应中转移的电子数之比为2:1,
故答案为:KClO3;H2O2;2:1;
本题解析:
本题难度:一般