NH3
参考答案:A
本题解析:A中铝和氢氧化钠反应只能生成偏铝酸钠。故选A。
点评:历年高考对铝的考查都不少,所以对考生的要求就是熟练掌握和铝相关的各种转化关系,以及氯化铝和氢氧化钠的相互滴加,偏铝酸钠和盐酸的相互滴加等试验。
本题难度:简单
2、选择题 下列物质中可用于治疗胃酸过多的是
[? ]
A.碳酸钠
B.氢氧化铝
C.氧化钙
D.碳酸钡
参考答案:B
本题解析:
本题难度:简单
3、选择题 铝合金在日常生活、建筑装潢、航空航天和汽车制造等方面均有着广泛的用途.下列关于铝合金具有广泛用途的分析不正确的是( )
A.铝元素在地壳中的含量高,储量丰富
B.铝容易形成致密的氧化膜,抗腐蚀性能好
C.铝化学性质稳定,常温下不与任何酸碱反应
D.铝的冶炼技术基本成熟,可以大量生产
参考答案:A、Al元素在地壳中是含量最多的金属元素,含量高,储量丰富,故A正确;
B、金属铝易被氧气氧化形成致密的氧化膜氧化铝,抗腐蚀性能好,故B正确;
C、金属铝化学性质活泼,常温下可以和酸反应,故C错误;
D、现在生活和生产中对金属铝的需求量大,金属铝的冶炼利用电解技术在工业生产中已经成熟,可以大量生产,故D正确.
故选C.
本题解析:
本题难度:简单
4、选择题 下列从海水中提取镁正确的方法是(?)
(提示:熔点:MgO 2 850℃ MgCl2 714℃)
A.海水 Mg(OH)2 Mg(OH)2 Mg Mg
B.海水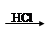 MgCl2溶液→MgCl2晶体 MgCl2溶液→MgCl2晶体 Mg Mg
C.海水 Mg(OH)2 Mg(OH)2 MgO MgO Mg Mg
D.海水 Mg(OH)2 Mg(OH)2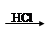 MgCl2溶液→MgCl2晶体 MgCl2溶液→MgCl2晶体 Mg Mg
参考答案:D
本题解析:首先是富集,海水加石灰乳生成Mg(OH)2沉淀、洗涤,洗涤后加盐酸生成MgCl2,因MgO熔点比MgCl2高,故电解MgO耗能多不经济,应电解MgCl2。
本题难度:简单
5、选择题 在含1mol KAl(SO4)2的溶液中逐滴加入2mol Ba(OH)2溶液,下列有关说法中正确的是
A.先生成沉淀,后沉淀全部溶解
B.当溶液中Al3+全部沉淀出来时,沉淀的总物质的量最大
C.最后得到的沉淀是BaSO4
D.最后的沉淀为2mol BaSO4、1mol Al(OH)?3
参考答案:AC
本题解析:KAl(SO4)2的电离方程式为:KAl(SO4)2=K++AL3++2SO42-;1mol KAl(SO4)2中含K+1mol,AL3+1mol,SO42-2mol,当逐滴加入Ba(OH)2溶液时,立即有AL(OH)3沉淀和BaSO4沉淀生成,当加入的Ba(OH)2的物质的量达到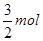 时,AL3+全部生成AL(OH)3沉淀,其物质的量为1mol;BaSO4的物质的量为 时,AL3+全部生成AL(OH)3沉淀,其物质的量为1mol;BaSO4的物质的量为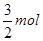 ;再加入 ;再加入 Ba(OH)2溶液时,又有 Ba(OH)2溶液时,又有 ?BaSO4生成,而AL(OH)3沉淀则全部恰好溶解生成ALO2-。即此时沉淀的质量达到最大。所以,正确的选项只有C。A错,沉淀最后为BaSO4;B错,当AL3+全部生成ALO2-沉淀的质量最大; ?BaSO4生成,而AL(OH)3沉淀则全部恰好溶解生成ALO2-。即此时沉淀的质量达到最大。所以,正确的选项只有C。A错,沉淀最后为BaSO4;B错,当AL3+全部生成ALO2-沉淀的质量最大;
本题难度:一般
|