微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 有可逆反应Fe(s)+CO2(g)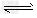 FeO(s)?+?CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2?。
FeO(s)?+?CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2?。
(1)能判断该反应达到平衡状态的依据是___________(填序号)。 ?
A.容器内压强不变了?
B.c(CO)不变了 ?
C.v正(CO2)=v逆(CO)?
D.c(CO2)=c(CO)
(2)该反应的正反应是_______(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式__________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0?mol/L,则该温度下上述反应的平衡常数K=__________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。 ?
①升高温度__________;②再通入CO___________。
(5)该反应的逆反应速率随时间变化的关系如下图:
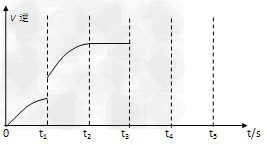
①从图中看到,反应在t2时达平衡,?在t1时改变了某种条件,改变的条件可能是______________________。 ?
A.升温?B.增大CO2浓度 C.使用催化剂
②如果在t3时从混合物中分离出部分CO,t4~?t5时间段反应处于新平衡状态,请在图上画出t3~?t5的V(逆)变化曲线。
参考答案:(1)BC
(2)吸热
(3)k=c(CO)/c(CO2);?1.0
(4)减小;不变
(5)①AC;?
② 
本题解析:
本题难度:一般
2、选择题 温度为T0时,在恒容的密闭容器中发生反应,各物质的浓度随时间变化的关系如图(a)所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图(b) 所示。下列叙述中正确的是

[? ]
A.该反应的正反应是放热反应
B.若在第6min时升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
C.图(a)中反应达到平衡时,Y时转化率为37.5%
D.反应中某时刻各物质的正反应速率关系为:2v(X)= 2v(Y)=v(Z)
参考答案:D
本题解析:
本题难度:一般
3、填空题 合成气是以H2、CO等为主要组成的供化学合成的原料气,回答有关问题: ?
(1)甲烷在一定条件下与水反应可得合成气,该反应中每转移1.2mol电子,所得合成气在表况下的体积为__________________L。
(2)合成气在合成氨气时需除去CO,可利用以下反应:CO(g)+H2O(g) CO2(g)+H2(g)?
CO2(g)+H2(g)? H=-41.16kJ/mol 对于该反应有关表述正确的是________________。
H=-41.16kJ/mol 对于该反应有关表述正确的是________________。
a.其他条件不变,缩小体系体积增大压强时反应速率不变,所以平衡不移动
b.绝热条件下,若测得该体系温度不再改变,则反应处于平衡状态
c.温度升高,该反应平衡常数增大
d.为提高CO转化率,可适当增加水蒸气用量
某温度下,H2O和CO按体积比5:l充入某恒容反应器,平衡时测得CO与CO2体积比l:9,则该条件下的平衡常数为____________?(保留两位有效数字)
(3)为除去(2)中生成的CO2,可用碳酸钾溶液吸收,常温下pH=10的碳酸钾溶液中水电离的OH-?的物质的量浓度为___________,碳酸氢钾溶液中离子浓度大小顺序为?____________
(4)CO2和NH3在一定条件下反应生成尿素[CO(NH2)2]:CO2(g)+2NH3(1)=H2O(1)+CO(NH2)2(1),CO2的转化率随温度变化曲线如下,则该反应 H?__________0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理______________。
H?__________0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理______________。

参考答案:(1)17.92L ?
(2)b?d?;2.0
(3)10-4mol/L?;[K+]>[HCO3-]>[OH-]>[H+]
(4)<?;净化后重新充入合成塔内,循环利用,提高原料利用率
本题解析:
本题难度:一般
4、填空题 在一定温度下,在1L容器中m?molSO2和n?mol?O2,反应达到平衡时有q?molSO2发生了反应,试填写下列空白:
(1)达到平衡时,c(SO2)=______
(2)平衡时气体总的物质的量为______
(3)在其它条件不变时,压缩容器使压强增大该反应的速率会______;或者减少SO2的量反应速率会______.
参考答案:(1)n(SO2)平衡=mmol-qmol=(m-q)mol,所以平衡时,c(SO2)=(m-q)mol1L=(m-q)mol/L,故答案为:(m-q)mol/L;
(2)2SO2+O2 ?2SO3,物质的量减少
?2mol? 1mol
?qmol? q2mol
所以平衡时气体总的物质的量为mmol+nmol-q2mol=(m+n-q2)mol,
故答案为:(m+n-q2)mol;
(3)压强增大反应加快,反应速率增大,降低反应物浓度反应速率减慢,则减少SO2的量会使反应速率减小.
故答案为:增大;减小.
本题解析:
本题难度:一般
5、选择题 一定温度下,向一个一定容积的密闭容器中放入2molX和3molY,发生反应:X(气)+Y(气)?mZ(气)+nR(气),达平衡时,Z的体积分数为φ1,维持温度不变,若把3molX和2molY放入另一体积相同的密闭容器,达平衡时,Z的体积分数为φ2,则φ1与φ?2的关系为( )
A.φ1>φ2
B.φ1<φ2
C.φ1=φ2
D.无法判断
参考答案:密闭容器中放入2molX和3molY,发生反应:X(气)+Y(气)?mZ(气)+nR(气),达平衡时,Z的体积分数为φ1;维持温度不变,若把3molX和2molY放入另一体积相同的密闭容器,达平衡时,Z的体积分数为φ2,x和y这两种气体的反应比为1:1,达到平衡时参与反应的量取决于最小者,即2molx和2moly反应生成z,生成的Z的量是相同的,容器体积不变,Z的条件分数相同;
故选C.
本题解析:
本题难度:一般