微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中发生了氧化还原反应的是( )
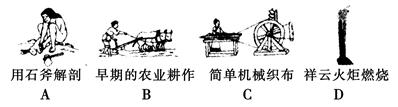
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
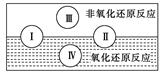
试写出有水参加、水为还原剂且为类型Ⅳ的一个化学方程式:_? _
(3)NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2的反应离子方程式是
?MnO4-+?NO2-+? ?=====?Mn2++?NO3-+?H2O
?=====?Mn2++?NO3-+?H2O
Ⅰ、请补充完整,配平方程式并标出电子转移方向和数目
Ⅱ、某同学称取了7.9 g KMnO4固体,欲配制100 mL溶液。回答下列问题:
该实验中,使用容量瓶时要检查是否漏水,其操作是:?。
Ⅲ、不规范的实验操作会导致实验结果的误差。分析下列操作对实验结果的影响偏小?(请填序号):
①在溶解过程中有少量液体溅出烧杯外
②定容时仰视仪器上的刻度线
③定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
IV、最后所得的溶液应存放在试剂瓶中,并贴上标签,请你填写该标签(如图)。

V、某同学用上述配好的KMnO4溶液滴定末知浓度的NaNO2溶液:
取20mL末知浓度的NaNO2溶液于锥形瓶;
取上述配好的KMnO4溶液于?(“酸式”或“碱式”)滴定管
滴定完成后消耗KMnO4溶液10mL则NaNO2溶液的浓度为?
参考答案:
?
?(1) (? D? )?(2)F2+2H2O==4HF+O2(3)Ⅰ、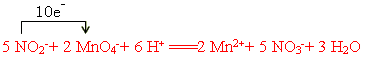
Ⅱ、往容量瓶中加入少量的蒸馏水,盖上瓶塞,倒置,看瓶塞是否漏水,放正,瓶塞旋转
180度,重新倒置,看是否漏水。
Ⅲ、?①②③? IV、0.5mol/L? KMnO4?V、酸式,0.625 mol/L
本题解析:(1)凡是有元素化合价升降的反应都是氧化还原反应,燃烧是氧化还原反应,D正确,ABC都是物理变化,答案选D。
(2)类型Ⅳ是置换反应,所以满足有水参加、水为还原剂反应是F2+2H2O==4HF+O2。
(3)Ⅰ、根据方程式可知,锰元素的化合价从+7价降低到+2价,得到5个电子。氮元素的化合价从+3价升高到+5价,失去2个电子,所以根据电子的得失守恒可知,配平后的方程式是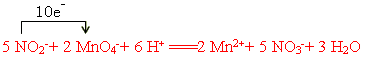 。
。
Ⅱ、检查容量瓶是否漏水的方法是往容量瓶中加入少量的蒸馏水,盖上瓶塞,倒置,看瓶塞
是否漏水,放正,瓶塞旋转180度,重新倒置,看是否漏水。
Ⅲ、根据c=n/V可知,在溶解过程中有少量液体溅出烧杯外,则溶质减少,浓度偏小;定容时仰视仪器上的刻度线,则容量瓶中溶液的体积增加,浓度偏小;又加入少量水至刻度线,则溶液体积增加,浓度偏小,答案选①②③。
IV、标签上面是溶液的浓度,下面是溶质的化学式。7.9 g KMnO4固体是0.05mol,所以浓
度是0.5mol/L。
?V、高锰酸钾溶液碱液氧化性,能腐蚀橡胶,应该用酸式滴定管。根据方程式可知,亚硝酸钠的浓度是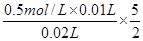 =0.625 mol/L。
=0.625 mol/L。
本题难度:一般
2、选择题 白磷为剧毒药品,当白磷中毒时可用CuSO4溶液解毒,反应方程式为:P+CuSO4+H2O→Cu3P↓+H3PO4+H2SO4(未配平),当0.5 mol P原子被还原时电子转移总数为(?)
A.3 mol
B.1.5 mol
C.1.806×1024个
D.9.03×1023个
参考答案:C
本题解析:由
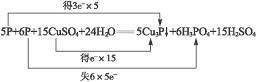
知5 mol P被还原得15 mol e-,转移了30 mol 电子,当0.5 mol P被还原时则转移3 mol e-,即转移电子总数为1.806×1024个,故C正确。
本题难度:简单
3、填空题 (10分) 按要求填空
(1)配平下列化学方程式:并用单线桥标出电子转移的方向和数目。
______Fe3O4 + ______CO = _____Fe+_______CO2
(2)检验SO42-所需要用的试剂__________________和___ _______________。
_______________。
(3)三硅酸镁(Mg2Si3O8·11H2O)用氧化物表示_______________________。
(4)0.3 mol NH3分子中所含质子数与________个H2O分子中所含质子数相等。
参考答案:(共10分)(1)(4分)
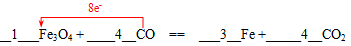
(2) BaCl2溶液和盐酸。(2分)
(3) 2MgO·3SiO2·11H2O(2分)
(4) 0.3NA或1.806×1023?(2分)
本题解析:略
本题难度:简单
4、选择题 高铁酸钠(Na2FeO4)是一种新型、高效、多功能的水处理剂。湿法制备的离子反应方程式: 2Fe(OH)3+3ClO-+4OH-→ 2FeO42-+3Cl-+5H2O;干法制备化学反应方程式:2FeSO4+4Na2O2→2Na2FeO4+2Na2SO4。有关分析错误的是
A.等物质的量Na2FeO4氧化能力优于次氯酸钠
B.湿法中氢氧化铁被氧化
C.干法中每生成1 mol Na2FeO4转移3 mol电子
D.高铁酸钠的氧化性大于次氯酸钠
参考答案:CD
本题解析:A.在体现氧化能力的过程中Na2FeO4到三价铁离子,次氯酸钠到氯离子,当等物质的量时转移的电子数Na2FeO4大于次氯酸钠的,故A正确。湿法中氢氧化铁中的铁元素化合价升高被氧化,正确。C.干法中每生成1 mol Na2FeO4应转移2 mol电子,错误。D.由2Fe(OH)3+3ClO-+4OH-→ 2FeO42-+3Cl-+5H2O反应再根据氧化剂的氧化性强于氧化产物的氧化性,高铁酸钠的氧化性弱于次氯酸钠,错误。
本题难度:一般
5、选择题 三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。反应原理为: C3N3(OH)3 3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2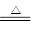 7N2+8CO2+4H2O,下列说法正确的是:(?)
7N2+8CO2+4H2O,下列说法正确的是:(?)
A.C3N3(OH)3与HNCO为同一物质
B.HNCO是一种很强的氧化剂
C.1 mol NO2在反应中转移的电子为4 mol
D.反应中NO2是还原剂
参考答案:C
本题解析:C3N3(OH)3与HNCO的结果与性质不同,所以不是同一种物质,选项A不正确;在反应8HNCO+6NO2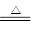 7N2+8CO2+4H2O中HNCO被氧化,作还原剂,NO2中氮元素的化合价从+4价降低到0价,作氧化剂,因此选项B、D不正确,C正确,答案选C。
7N2+8CO2+4H2O中HNCO被氧化,作还原剂,NO2中氮元素的化合价从+4价降低到0价,作氧化剂,因此选项B、D不正确,C正确,答案选C。
本题难度:一般