微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是(?)
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO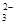 和OH-
和OH-
B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C.10 mL0.20mol·L-1CH3COOH溶液加入10 mL0.10mol·L-1的NaOH后,溶液中:c(CH3COO-)+c(CH3COOH)= 0.10mol·L-1
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
参考答案:C
本题解析:A.在NaHCO3溶液中加入与其等物质的量的NaOH,恰好发生发生反应:NaHCO3+NaOH= Na2CO3+ H2O,得到Na2CO3。由于该盐是强碱弱酸盐。在溶液中会发生水解反应:Na2CO3+ H2O NaHCO3+NaOH。因此溶液中的阴离子有CO
NaHCO3+NaOH。因此溶液中的阴离子有CO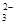 和OH-及HCO3-。错误。B.在NaHCO3溶液中:根据电荷守恒可得c(H+)+c(Na+) =c(OH-)+2c(CO
和OH-及HCO3-。错误。B.在NaHCO3溶液中:根据电荷守恒可得c(H+)+c(Na+) =c(OH-)+2c(CO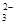 )+c(HCO3-);根据物料守恒可得c(Na+)= c(CO
)+c(HCO3-);根据物料守恒可得c(Na+)= c(CO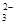 )+c(HCO3-)+c(H2CO3)。两式相减可得c(OH-)+c(CO
)+c(HCO3-)+c(H2CO3)。两式相减可得c(OH-)+c(CO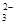 )= c(H+)+c(H2CO3)。错误。C两溶液混合后得到的为等物质的量的CH3COOH与CH3COONa的混合物。根据元素守恒可得c(CH3COO-)+c(CH3COOH)= 0.10mol/L.正确。D.由于HCl是强酸,完全电离所以c(HCl)=c(H+);醋酸是弱酸,部分电离,c(CH3COOH)>> c(H+)。所以在体积与pH都相同的HCl溶液和CH3COOH溶液中含有的溶质的物质的量n(CH3COOH)>>n(HCl)因此所消耗的NaOH物质的量CH3COOH多。错误。
)= c(H+)+c(H2CO3)。错误。C两溶液混合后得到的为等物质的量的CH3COOH与CH3COONa的混合物。根据元素守恒可得c(CH3COO-)+c(CH3COOH)= 0.10mol/L.正确。D.由于HCl是强酸,完全电离所以c(HCl)=c(H+);醋酸是弱酸,部分电离,c(CH3COOH)>> c(H+)。所以在体积与pH都相同的HCl溶液和CH3COOH溶液中含有的溶质的物质的量n(CH3COOH)>>n(HCl)因此所消耗的NaOH物质的量CH3COOH多。错误。
本题难度:一般
2、选择题 在已达到电离平衡的0.1 mol·L一的醋酸溶液中,欲使平衡向电离的方向移动,同时使溶液的pH降低,应采取的措施是? (? )
A.加少量盐酸
B.加热
C.加少量醋酸钠晶体
D.加氢氧化钠
参考答案:B
本题解析:A、加入少量盐酸,H+浓度增大,醋酸的电离平衡向左移动,错误;B、因为弱酸的电离吸热,所以加热使醋酸的电离平衡向右移动,H+浓度增大,pH降低,正确;C、加入少量醋酸钠晶体,平衡向左移动,H+浓度减小,pH增大,错误;D、加入NaOH,中和CH3COOH,H+减小,pH增大,错误。
本题难度:一般
3、填空题 (12分)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在着一种定量关系:如25 ℃时,HA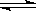 H++A-,则K=
H++A-,则K=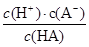 ,式中K为电离平衡常数,只与温度有关,c为平衡浓度。下表是几种弱酸的电离平衡常数(25 ℃)。
,式中K为电离平衡常数,只与温度有关,c为平衡浓度。下表是几种弱酸的电离平衡常数(25 ℃)。
酸
| 电离方程式
| 电离平衡常数K
|
CH3COOH
| CH3COOH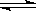
H++CH3COO-
| 1.75×10-5
|
H2CO3
| H2CO3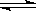 H++HCO3- H++HCO3-
HCO3-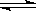 H++CO32- H++CO32-
| K1=4.4×10-7 K2=4.7×10-11
|
H2S
| H2S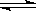 H++HS- H++HS-
HS-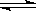 H++S2- H++S2-
| K1=1.3×10-7 K2=7.1×10-15
|
H3PO4
| H3PO4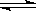 H++H2PO4- H++H2PO4-
H2PO4-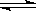 H++HPO42- H++HPO42-
HPO42-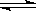 H++PO43- H++PO43-
| K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13
|
回答下列问题:
(1)K只与温度有关,当温度升高时,K值________(填“变大”、“变小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性相对强弱的关系是_____________________________________________________________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,其中酸性最强的是________,酸性最弱的是________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3,总有: ,产生此现象的原因是________________________________________________________________________。
参考答案:(1)变大 (2)K值越大,酸性越强 (3)H3PO4 HS- (4)当多元弱酸电离出1个H+后,便带一个单位负电荷,再电离时相当于在负电荷的束缚下电离出带正电荷的H+,故越来越难电离,K越来越小 (5) K1?K2?K3
本题解析: (1)弱酸的电离是吸热反应,升高温度促进弱酸电离,所以电离平衡常数增大,故答案为:增大;
(2)同一温度下,酸的电离常数越大其电离程度越大,则酸性越强,故答案为:Ka值越大酸性越强;
(3)同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数知,酸性最强的是H3PO4,最弱的是HPO42-,故答案为:H3PO4;HPO42-;
(4)产生相同离子时抑制电解质的电离,多元弱酸电离时上一级电离产生的H+对下一级电离有抑制作用,所以其电离常数逐渐减小,故答案为:上一级电离产生的H+对下一级电离有抑制作用.
考点:弱电解质的电离平衡。
本题难度:一般
4、选择题 用食用白醋(醋酸浓度约1 mol/L)进行下列实验,能证明醋酸为弱电解质的是
[? ]
A.白醋中滴入石蕊试液呈红色
B.白醋加入豆浆中有沉淀产生
C.蛋壳浸泡在白醋中有气体放出
D.pH试纸显示白醋的pH为2~3
参考答案:D
本题解析:
本题难度:简单
5、选择题 稀氨水中存在下述平衡: 改变下列条件,能使电离程度增大的是
改变下列条件,能使电离程度增大的是
A.加浓氨水
B.升高温度
C.加NH4Cl溶液
D.加NaOH溶液
参考答案:B
本题解析:A、加浓氨水,电离平衡正向移动,但一水合氨的电离程度减小,错误;B、弱电解质的电离吸热,升高温度,平衡正向移动,电离程度增大,正确;C、向氨水中加入NH4Cl溶液,溶液中c(NH4+)增大,平衡逆向移动,电离程度减小,错误; D、向氨水中加入NaOH溶液,氢氧根离子浓度增大,电离平衡向逆反应方向移动,电离程度减小,错误。
本题难度:简单