微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在新型有机高分子材料中,有一种感光高分子材料,也称为光敏高分子,是一种在彩电光屏及大规模集成电路的制造中使用的功能高分子材料,其结构简式为:
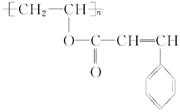
已知它是由两种化合物经酯化后聚合而成的,这两种化合物的结构简式为:__________________________。
参考答案: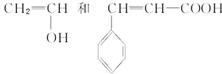
本题解析:从乙烯合成聚乙烯可知加聚反应中单体与高聚物之间有如下特点:单体与高聚物结构单元的原子种类和数目完全相同,并且单体的碳链和高聚物分子链节中的碳链也相同,仅存在双键变单键的变化。本题中高聚物分子链节的主链上只存在两个碳原子,因此只将高聚物分子式中的括号与聚合度n去掉,然后将主链上的单键变为双键即可得到加聚反应前的单体:
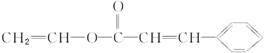
该单体存在酯的结构,根据酯的特点可拆分得出合成单体的两种化合物分别为:
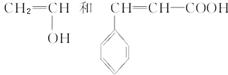
本题难度:简单
2、填空题 TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业。工业上利用TiO2制备金属钛的流程如下。
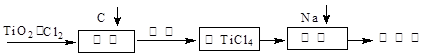
已知:I.
Ti(s)+O2(g)=TiO2(s)?△H=-946 kJ·mol-1
2C(s)+O2(g)=2CO(g)?△H=-221 kJ·mol-1
Ti(s)+2Cl2(g)=TiCl4(g)?△H=-815 kJ·mol-1
II.某温度下各物质的沸点如下:
物质
| TiCl4
| FeCl3
| SiCl4
| AlCl3
|
沸点/℃
| 136
| 310
| 56.5
| 180
|
?
回答下列问题:
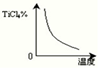
(1)在氯化工序中发生反应:TiO2(s)+2Cl2(g)+2C(s)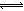 TiCl4(g)+2CO?(g) 。试计算其反应的△H=??kJ?mol-1;反应的平衡常数表达式K=?,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
TiCl4(g)+2CO?(g) 。试计算其反应的△H=??kJ?mol-1;反应的平衡常数表达式K=?,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。

(2)氯化过程中带入的副产物有FeCl3、SiCl4和AlCl3,可用?方法获得较纯净的TiCl4。
(3)TiO2与Cl2反应:TiO2(s)+2Cl2(g)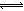 TiCl4(l)+O2(g)△H=+151kJ?mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因?
TiCl4(l)+O2(g)△H=+151kJ?mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因?
(4)还原工序要在惰性气体的气氛中进行的理由是_______________________。
(5)制取Ti的新工艺是用二氧化钛作阴极,以石墨为阳极,以CaCl2熔盐做电解质(在熔融状态下能传导O2-),电解而得到Ti,该工艺具有操作简单,成本低,无污染等优点,写出电解制备金属钛时阴极的电极反应式:?。
参考答案:(16分)
(1)—90?(2分);
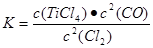 (平衡常数2分,作图2分,共4分)
(平衡常数2分,作图2分,共4分)
(2)蒸馏(分馏) (2分)
(3)降低生成物O2浓度,平衡向正方向移动 (或者碳与氧气反应放热,升高温度,导致平衡向吸热反应方向或正反应方向移动,3分)
(4)防止高温下Na(Ti)与空气中的O2(或CO2)作用(2分)
(5)TiO2+4e-=Ti+2O2-?(3分)
本题解析:(1)先将已知热化学方程式编号为①②③,观察发现③—①+②可以约去Ti(s)、O2(g),根据盖斯定律,可以得到热化学方程式:TiO2(s)+2Cl2(g)+2C(s)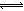 TiCl4(g)+2CO?(g)?△H=-90 kJ·mol-1;根据平衡常数定义可知,
TiCl4(g)+2CO?(g)?△H=-90 kJ·mol-1;根据平衡常数定义可知,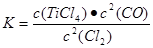 ;由于正反应的△H=-90 kJ·mol-1,正反应是放热反应,升高温度,平衡向吸热反应方向或逆反应方向移动,则TiCl4的百分含量逐渐减小,即随着温度的升高,TiCl4的百分含量逐渐减小;(2)读表中信息,TiCl4的沸点与杂质相差较大,因此可以利用沸点差异大的性质,选择蒸馏或分馏进行分离提纯;(3)从外界条件对化学平衡移动的角度分析,加入碳后,碳能与氧气反应生成二氧化碳,即C(s)+O2(g)=CO2(g),减小氧气浓度,使平衡向正反应方向移动;同时碳与氧气反应放出热量,使体系温度升高,由于正反应是吸热反应,则升温平衡向正反应方向移动;(4)还原工序中加入的钠是强氧化剂,容易被空气中氧气或水、二氧化碳等物质氧化,在惰性气体氛围中能防止高温下Na(Ti)与空气中的O2(或CO2)作用,提高钛的产率;(5)根据电解原理,阴极的主要反应物和产物分别是二氧化钛和单质钛,即TiO2→Ti;由于钛元素由+4价降为0价,得到4个电子,则TiO2+4e—→Ti;由于内电路中熔融电解质中氧离子可以传导,因此用氧离子使左右电荷守恒,即TiO2+4e—→Ti+2O2—;所以,阴极反应式为TiO2+4e-=Ti+2O2-。
;由于正反应的△H=-90 kJ·mol-1,正反应是放热反应,升高温度,平衡向吸热反应方向或逆反应方向移动,则TiCl4的百分含量逐渐减小,即随着温度的升高,TiCl4的百分含量逐渐减小;(2)读表中信息,TiCl4的沸点与杂质相差较大,因此可以利用沸点差异大的性质,选择蒸馏或分馏进行分离提纯;(3)从外界条件对化学平衡移动的角度分析,加入碳后,碳能与氧气反应生成二氧化碳,即C(s)+O2(g)=CO2(g),减小氧气浓度,使平衡向正反应方向移动;同时碳与氧气反应放出热量,使体系温度升高,由于正反应是吸热反应,则升温平衡向正反应方向移动;(4)还原工序中加入的钠是强氧化剂,容易被空气中氧气或水、二氧化碳等物质氧化,在惰性气体氛围中能防止高温下Na(Ti)与空气中的O2(或CO2)作用,提高钛的产率;(5)根据电解原理,阴极的主要反应物和产物分别是二氧化钛和单质钛,即TiO2→Ti;由于钛元素由+4价降为0价,得到4个电子,则TiO2+4e—→Ti;由于内电路中熔融电解质中氧离子可以传导,因此用氧离子使左右电荷守恒,即TiO2+4e—→Ti+2O2—;所以,阴极反应式为TiO2+4e-=Ti+2O2-。
本题难度:困难
3、选择题 将过量的CO2分别通入①CaCl2溶液,②Na2SiO3溶液,③Ca(ClO)2溶液,④饱和Na2CO3溶液,最终有沉淀析出的是( )
A.①②③④
B.②④
C.①②③
D.②③
参考答案:B
本题解析:
本题难度:简单
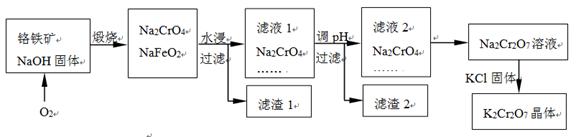
4、填空题 铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
已知:① NaFeO2遇水强烈水解。?② Cr2O72-+ H2O 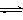 ?2CrO42- + 2H+
?2CrO42- + 2H+
 K2Cr2O7中Cr元素的化合价是?。
K2Cr2O7中Cr元素的化合价是?。
生成滤渣1中红褐色物质反应的化学方程式是?。
滤液1的成分除Na2CrO4、Na2SiO3外,还含有(填化学式)?。
利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是?。
由滤液2转化为Na2Cr2O7溶液应采取的措施是?。
向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、?、过滤、洗涤、干燥。
煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是?。
参考答案:+6 (1分) ;NaFeO2+2H2O→Fe(OH)3↓+NaOH; NaOH、NaAlO2
2Al2O3(熔融)  4Al + 3O2↑?加硫酸酸化;冷却结晶 (1分)
4Al + 3O2↑?加硫酸酸化;冷却结晶 (1分)
4FeO·Cr2O3 + 7O2 + 20NaOH 8Na2CrO4 + 4NaFeO2+ 10H2O
8Na2CrO4 + 4NaFeO2+ 10H2O
本题解析:(1)根据化合物化合价的代数和为0可知,K2Cr2O7中Cr元素的化合价是+(2×7-1×2)÷2=+6价。
(2)由于NaFeO2遇水强烈水解,则生成滤渣1中红褐色物质反应的化学方程式是NaFeO2+2H2O→Fe(OH)3↓+NaOH。由于矿石中还含有氧化铝,且氢氧化钠是过量的,则滤液1的成分除Na2CrO4、Na2SiO3外,还含有NaOH、NaAlO2。
(3)由于滤液中含有偏铝酸钠,则可以制备氧化铝,电解熔融的氧化铝可以制备金属铝,反应的化学方程式是2Al2O3(熔融)  4Al + 3O2↑.
4Al + 3O2↑.
(4)根据方程式Cr2O72-+ H2O  ?2CrO42- + 2H+可知,由滤液2转化为Na2Cr2O7溶液应采取的措施是加硫酸酸化;获得K2Cr2O7晶体的操作依次是:加热浓缩、冷却结晶、过滤、洗涤、干燥。
?2CrO42- + 2H+可知,由滤液2转化为Na2Cr2O7溶液应采取的措施是加硫酸酸化;获得K2Cr2O7晶体的操作依次是:加热浓缩、冷却结晶、过滤、洗涤、干燥。
(5)根据原子守恒可知,煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是4FeO·Cr2O3 + 7O2 + 20NaOH 8Na2CrO4 + 4NaFeO2+ 10H2O。
8Na2CrO4 + 4NaFeO2+ 10H2O。
点评:该题是高考中的常见题型,难度大,综合性强,对学生的要求高。试题在注重对基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生规范严谨的实验设计能力以及评价能力。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
5、选择题 钢笔的笔头是合金钢,其笔头尖端是用机器轧出的便于使用的圆珠体。为了改变笔头的耐磨性能,在笔头尖端点上铱金粒,为区别钢笔而叫铱金笔,铱金笔是笔头用黄金的合金、笔尖用铱的合金制成的高级自来水笔。下列说法中错误的是
A.钢笔的笔头不易被氧化,抗腐蚀性能好
B.铱金笔的耐磨性能比钢笔要好
C.铱金笔的笔头和笔尖都是用纯金制成的
D.铱金笔经久耐磨,书写时弹性特别好,是一种理想的硬笔
参考答案:C
本题解析:钢笔的笔头是合金钢制成的,所以钢笔的笔头不易被氧化,抗腐蚀性能好,所以A正确。“为了改变笔头的耐磨性能”,所以铱金笔的耐磨性能比钢笔要好,所以B、D项正确。铱金笔是笔头用黄金的合金、笔尖用铱的合金制成的,所以C项错误。
点评:读懂信息基础上,注意和信息有差异的地方着重分析,此题属于简单题型。
本题难度:一般