| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《pH计算》试题强化练习(2017年最新版)(十)
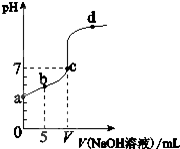 参考答案:A.由图象知,0.01mol/L的HA溶液的pH值约为4,不能完全电离,为弱酸,故A正确; 本题解析: 本题难度:一般 3、选择题 下列叙述正确的是( ) 参考答案:A、酸性溶液稀释,酸性减弱,溶液的pH值增大,故某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a<b,故A错误; 本题解析: 本题难度:一般 4、填空题 (1)氯化铁水解的离子方程式为__________,向氯化铁溶液中加入碳酸氢钠溶液,发现有红褐色沉淀生成,并产生无色气体,其离子方程式为____________。 参考答案:(1)Fe3+?+?3H2O 本题解析: 本题难度:一般 5、选择题 常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中的关系正确是( ) 参考答案:B 本题解析: 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《氯气的化学.. | |