| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《盐类水解的原理》考点预测(2017年强化版)(二)
参考答案:D 本题解析:根据NH4+ +H2O 本题难度:一般 2、选择题 将0.1mol下列物质置于1L水中充分搅拌后,溶液中阴离子数最多的是 参考答案:C 本题解析: 本题难度:一般 3、选择题 下列电离方程式中,正确的是 参考答案:B 本题解析:分析:A、硫酸铝是强电解质溶液中完全电离生成离子,标注离子所带电荷错误; 本题难度:困难 4、选择题 将0.1mol/L的下列物质的水溶液从常温加热到80℃,溶液的pH值不变的是 |
参考答案:B
本题解析:加热时,弱电解质的电离程度增大,水电离程度及盐的水解程度增大、Kw也增大,A、C、中溶液的pH变小;D.碱溶液的pH取决于碱电离出的c(OH-)的大小,c(H+)=Kw/c(OH-),pH变小;
B.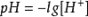 ,无论温度高低,氢离子的浓度不变,PH不变,选B。
,无论温度高低,氢离子的浓度不变,PH不变,选B。
考点:考查溶液的PH。
本题难度:一般
5、填空题 已知在0.1mol?L-1的NaHSO3溶液中有关微粒浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3).
(1)该溶液中c(H+)______c(OH-)(填“>”“=”或“<”),简述理由(用离子方程式表示):______.
(2)现向NH4HSO3溶液中,逐滴加入少量含有酚酞的NaOH溶液,可观察到的现象是______;写出该反应的离子方程式:______.
参考答案:(1)由于NaHSO3溶液中,c(SO32-)>c(H2SO3),说明亚硫酸氢钠的电离程度大于水解程度,反应的离子方程式为:HSO3-?H++SO32-、HSO3-+H2O?OH-+H2SO3;
故答案为:>;HSO3-?H++SO32-、HSO3-+H2O?OH-+H2SO3,且电离程度大于水解程度;
(2)逐滴加入少量含有酚酞的NaOH溶液,发生了反应,HSO3-+OH-═SO32-+H2O,氢氧化钠溶液的红色会褪去;
故答案为:红色褪去; HSO3-+OH-═SO32-+H2O.
本题解析:
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《物质的量》.. | |