微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃时,某溶液中由水电离产生的C(H+)和C(OH-)的乘积为1×10-20,下列说法正确的是
A.该溶液的pH一定是10
B.该溶液不可能pH="4"
C.该溶液的pH不可能是7
D.不会有这样的溶
参考答案:C
本题解析:由题意可知由水电离的C(H+)=C(OH-)=1×10-10mol/L<1×10-7mol/L,说明水的电离受抑制,可能是酸溶液也可能是碱溶液
当是酸溶液时,溶液中的OH-全部来自于水的电离,溶液中的C(H+)=1×10-4mol/L,pH=4
当是碱溶液时,溶液中的H+全部来自于水的电离,溶液中的C(H+)=1×10-10mol/L,pH=10
故答案为C
本题难度:一般
2、选择题 对于相同物质的量浓度、相同体积的盐酸和醋酸,下列几种说法正确的是?
A.它们起始时溶液中的c(H+)相同
B.各用水稀释一倍后,pH比较:盐酸>醋酸
C.分别和同浓度的氢氧化钠溶液反应至pH=7,所用氢氧化钠溶液的体积不同
D.各与足量的锌粒充分反应,产生H2的量不同
参考答案:C
本题解析:略
本题难度:简单
3、计算题 (10分)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5 mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示。则
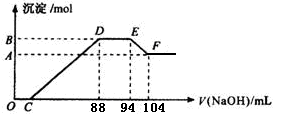
⑴B与A的差值为?mol。
⑵C点对应的溶液体积为?mL。
⑶原硝酸溶液中含硝酸的物质的量为?mol。
⑷铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为?。
⑸写出铝与该浓度硝酸反应的离子方程式?。
参考答案:⑴0.05 ⑵40? ⑶0.5? ⑷5:3?
⑸8Al+30H++3NO3-=8Al3++3NH4++9H2O
本题解析:由题意知,金属与硝酸反应时,硝酸的还原产物为NH4NO3,由图又可看出金属与硝酸反应后,硝酸是过量的,故金属的氧化产物为Fe(NO3)3、Al(NO3)3。图中:①0→C:H++OH-=H2O;②C→88:R3++3OH-=R(OH)3↓(R代表Fe或Al);③88→94:NH4++ OH-=NH3?H2O;④94→104:Al(OH)3+ OH-=AlO2-+ 2H2O。由④知n[Al(OH)3]=0.01L×5mol·L-1="0.05" mol=n(Al),此值也是B与A的差值。由③知,n(NH4NO3)=0.006L×5mol·L-1=0.03mol,根据反应中得失电子相等的原则得:3n(R3+)="0.03×8=0.24" mol,则n(R3+)="0.08" mol=n(合金),故混合物中n(Al):n(Fe)=5:3。0→88mL中,用于沉淀金属离子的OH-有0.08 mol×3="0.24" mol,故C点:(0.088L×5 mol·L-1-0.24 mol)÷5 mol·L-1=0.04L,即40mL。
本题难度:一般
4、选择题 25℃时将水不断滴入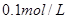 的氨水中,下列变化的图象合理的是
的氨水中,下列变化的图象合理的是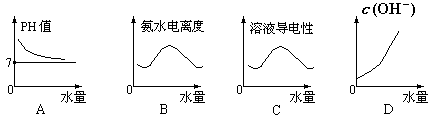
参考答案:A
本题解析:A正确,加水稀释,氨水的浓度不断减少,PH值降低,无限趋向于PH=7。
B错误,加水稀释,促进电离,氨水电离度增大。
C错误,加水稀释,离子浓度减少,导电能力减弱。
D错误,稀释的时候,OH-浓度不断减小。
本题难度:一般
5、选择题 将0.1mol L-1的下列物质的水溶液,从常温加热到90℃,溶液的pH不变的是
A.氯化钠
B.硫酸
C.氢氧化钠
D.葡萄糖
参考答案:B
本题解析:氯化钠和葡萄糖溶液常温呈中性,pH=7,加热到90℃,Kw增大,c(H+)=c(OH-),溶液仍呈中性,但Kw增大,c(H+)和c(OH-)均增大,pH减小;0.1mol/L硫酸中c(H+)=0.2mol/L,加热到90℃,c(H+)不变,pH不变;0.1mol/LNaOH溶液中c(OH-)=0.1mol/L,升温到90℃,c(OH-)不变,但Kw增大,所以c(H+)增大,pH减小。
点评:水的电离是吸热过程,升高温度,Kw增大。
本题难度:一般