| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《离子方程式的书写及正误判断》试题预测(2017年最新版)(六)
参考答案:D 本题解析: 本题难度:一般 2、选择题 下表中评价合理的是
参考答案: 本题解析: 本题难度:一般 3、选择题 某科研小组从含有较多Ag+、Fe3+、Al3+的工业废水中,按下图所示方法分离和提取金属单质: 参考答案:B 本题解析:根据题给流程图和试剂结合相关物质的性质分析知,甲为氨水溶液a为银氨溶液,乙为葡萄糖,金属A为银;沉淀b为氢氧化铁和氢氧化铝的混合物,丙为氢氧化钠溶液,溶液e为偏铝酸钠溶液,丁为碳酸铵溶液,沉淀d为氢氧化铝,g为氧化铝,金属B为铝;沉淀e为氢氧化铁,f为氧化铁,金属C为铁;综上所述选B。 本题难度:一般 4、填空题 研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
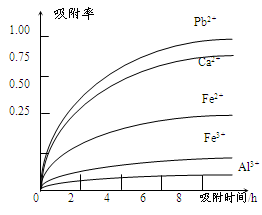 请回答下列问题: (1)写出浸出过程中生成Mn2+反应的化学方程式 。 (2)氧化过程中主要反应的离子方程式 。 (3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是 ,应调节pH的范围为 。 (4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有 、 等;吸附步骤除去的主要离子为: 。 (5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2 mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是 。 参考答案:(1)SO2+MnO2=MnSO4 (2)2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O; 本题解析:(1)根据题意在浸出过程中生成Mn2+反应的化学方程式为SO2+MnO2=MnSO4;(2)将Fe2+氧化为Fe3+过程中主要反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O。(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计。使Fe3+沉淀完全的pH为3.7,而Mn2+开始形成沉淀的pH为8.3。因此应调节pH的范围为4.7 ≤pH<8.3。(4)根据题目提供的表格数据可知决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子的半径 、金属离子的电荷;吸附步骤除去的主要离子为Pb2+、Ca2+。(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol/LCaCl2溶液与2.00×10—2 mol/LNa2SO4溶液等体积混合,由于忽略体积的变化,所以混合后氯化钙和硫酸钠溶液的浓度都要减半;c(SO42-)=1.00×10—2 mol/L. c(Ca2+)=c/2mol/L.由于Ksp(CaSO4)= 9.10×10—6,c(SO42-)·c(Ca2+)≥9.10×10—6,则生成沉淀时c(Ca2+)≥(9.10×10—6÷1.00×10—2 mol/L)×2=1.82×10-3mol/L。因此c的最小值是1.82×10-3mol/L. 本题难度:困难 5、填空题 亚铁盐不稳定,在空气中易被氧化,因此在存放FeSO4溶液时,常加入 ,其理由是 (用离子方程式表示)。 参考答案:铁(合理答案均可) 2Fe3++ Fe ="3" Fe2+ 本题解析:亚铁盐不稳定,在空气中易被氧化生成铁盐,所以在存放FeSO4溶液时,常加铁粉。因为铁离子能和铁反应生成亚铁离子,方程式是2Fe3++ Fe ="3" Fe2+。 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《阿伏伽德罗常数》.. | |