微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 高功率Ni/MH(M表示储氢合金)电池已经用于混合动力汽车。总反应方程式如下:
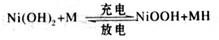
下列叙述不正确的是
A.该电池放电时的正极和充电时的阴极均发生还原反应
B.放电时负极反应为:MH+OH——e—=M+H2O
C.充电时阳极反应为:NiOOH+H2O+e—=Ni(OH)2+OH—
D.放电时每转移1mol电子,正极有1molNiOOH被还原
参考答案:C
本题解析:A项该电池放电时的正极发生还原反应,充电时的阴极均发生还原反应,正确;B项放电时负极反应为:MH+OH——e—=M+H2O,正确;C项充电时阳极反应不正确,应该是Ni(OH)2+OH—-e—= NiOOH+H2O,错误;D项根据电极反应,放电时每转移1mol电子,正极有1molNiOOH被还原,正确。
点评:对于可充电电池,原电池的负极就是电解池的阴极的逆反应。
本题难度:简单
2、选择题 下图是一种航天器能量储存系统原理示意图。下列说法正确的是

[? ]
A.该系统中只存在3种形式的能量转化
B.装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH-
C.装置X能实现燃料电池的燃料和氧化剂再生
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
参考答案:C
本题解析:
本题难度:一般
3、选择题 碱性锌锰电池工作时的总方程式为:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。关于碱性锌锰电池的说法正确的是
A.碱性锌锰电池是二次电池
B.正极反应为:2 MnO2+2H2O+2e-=2MnOOH+2OH-
C.连续工作后的碱性锌锰电池中电解液的pH将减小
D.工作中,每转移0.2mole?-时,负极质量减轻6.5g
参考答案:B
本题解析:本题考查电化学的知识,属中档题。碱性锌锰电池不可充电再使用,属于一次电池,A项错;Zn从零价升至+2价,失去电子为负极,电极反应为:Zn -2e-+2OH-=Zn(OH)2,用总反应减去负极反应,即可得正极反应,B项正确。生成的MnOOH和Zn(OH)2均含有OH-,故电解液pH将增大,C项错;D项,负极由Zn生成Zn(OH)2,因此应该是负极质量增加,而Zn自身的质量减小。
本题难度:一般
4、填空题 (10分)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:2H2+O2===2H2O.试回答下列问题:
(1)若电解质溶液为KOH溶液,构成燃料电池,则:
①负极反应式为________________,
②工作一段时间后,溶液pH________(填“增大”或“减小”或“不变”).
(2)如把KOH改为稀H2SO4作电解质,则:
①正极反应式为________________,
②工作一段时间后,溶液pH________(填“增大”或“减小”或“不变”).
(3)如把H2改为甲烷,KOH作电解质,则正极反应式为____________________.
参考答案:(1)①2H2+4OH--4e-===4H2O?②减小
(2)①?O2+4H++4e-===2H2O② 增大 (3)O2+2H2O+4e-===4OH-
本题解析::
(1)①该反应中氢气失电子被氧化,氢气失电子生成氢离子,氢离子和溶液中的氢氧根离子生成水,所以电极反应式为2H2+4OH--4e-=4H2O;
②随着反应的进行,生成的水越来越多,溶质氢氧化钾的量不变,所以导致溶液的浓度降低,所以溶液的pH值减小;
(2)该反应中氢气失电子被氧化,氢气失电子生成氢离子,所以电极反应式为2H2-4e-═4H+;
②氧气得电子被还原,氧气得电子和溶液中的氢离子生成水,所以电极反应式为O2+4H++4e-═2H2O;随着反应的进行,生成的水越来越多,溶质硫酸的量不变,所以导致溶液的浓度降低,所以溶液的pH值增大;
(3)负极上甲烷燃烧生成二氧化碳和水,甲烷失电子发生氧化反应生成二氧化碳,二氧化碳和溶液中的氢氧化钾反应生成碳酸钾和水;正极上氧气得电子和水反应生成氢氧根离子,所以电极反应式为.O2+2H2O+4e-═4OH-。
本题难度:一般
5、计算题 铅蓄电池属于二次电池,其电极材料分别是Pb和PbO2,电解质溶液为一定浓度的硫酸,工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O;PbSO4不溶。
(1)该蓄电池工作时负极的电极反应式为?
(2)将质量相等的铁棒和石墨棒分别插入CuSO4溶液中,铁棒接该蓄电池Pb极,石墨棒接该蓄电池PbO2极,一段时间后测得铁棒比石墨棒增加了3.2克,则CuSO4溶液质量?(增加、减少)?克;如果要求将CuSO4溶液恢复成与开始时完全相同,则可以加入下列物质中的?
A.CuSO4溶液
B.CuCO3固体
C.CuO固体
D.Cu(OH)2固体