微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列事实与结论相符且正确的是
[? ]
A.100 mL 0.1 mol·L-1 AlCl3溶液中含有Al3+数目为0.01NA (NA代表阿伏加德罗常数)
B.Ksp(BaSO4) =1.07×10-10,Ksp(BaCO3)=2.58×10-9,所以不能将BaSO4转化为BaCO3
C.常温下,pH=11的NaOH溶液和pH=3的CH3COOH溶液等体积混合后,溶液pH<7
D.0.1 mol·L-1 Na2CO3溶液中:c(Na+)>c(CO32-)> c(HCO3-)>c(OH-)>c(H+)
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.1L0.1mol?L-1(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-)
B.25℃时,等体积、等浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
C.25℃时,BaCO3饱和溶液(Ksp=8.1×10-9):c(Ba2+)=c(CO32-)>c(H+)=c(OH-)
D.1.0?mol?L-1?Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
参考答案:A、1L0.1mol?L-1(NH4)2Fe(SO4)2溶液中铵根离子浓度大于亚铁离子浓度水解显酸性得到溶液中离子浓度大小为:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-),故A正确;
B、25℃时,等体积、等浓度的NaX和弱酸HX混合后的溶液中,无法判断酸的电离程度和阴离子的水解程度,不能比较离子浓度大小,故B错误;
C、25℃时,BaCO3饱和溶液(Ksp=8.1×10-9)中碳酸根离子水解溶液中的离子浓度爱心为:c(Ba2+)>c(CO32-)>c(OH-)>c(H+),故C错误;
D、1.0?mol?L-1?Na2CO3溶液中依据水电离出的全部氢离子和氢氧根离子守恒分析得到:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故D正确;
故选AD.
本题解析:
本题难度:一般
3、选择题 关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
[? ]
A.溶液的pH:①>③>②
B.水电离出的c(H+):③>②>①
C.①和②等体积混合后的溶液:c(H+)=c(OH-)+ c(NH3·H2O)
D.①和③等体积混合后的溶液呈碱性:c(NH4+)> c(Cl-)>c(OH-)>c(H+)
参考答案:B
本题解析:
本题难度:一般
4、选择题 常温下,下列物质的水溶液的PH大于7的是( )
A.Na2CO3
B.Na2SO4
C.NH4Cl
D.KCl
参考答案:A
本题解析:
本题难度:一般
5、选择题 25℃时,向体积为10mL 0.1mol/L NaOH溶液中逐滴加入0.1mol/L的CH3COOH溶液,曲线如图所示,有关离子浓度关系的比较中,错误的是
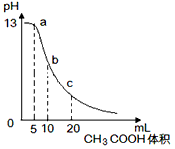
[ ? ]
A.a点处:c(Na+)> c(CH3COO-)> c(OH-)>c(H+)
B.b点处:c(CH3COOH)+c(H+)=c(OH-)
C.c点处:c(CH3COOH)+ c(CH3COO-)=2c(Na+)
D.NaOH溶液和CH3COOH溶液任意比混合时:c(Na+)+c(H+)=c(OH-)+ c(CH3COO-)
参考答案:A
本题解析:
本题难度:一般