微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 硫代硫酸钠溶液与稀硫酸反应的化学方程式为:
Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O四个试管中都装有5 mL 0.1 mol/L? Na2S2O3溶液,分别在不同温度下加入0.1 mol/L H2SO4和一定量水,最先出现浑浊的是
A.20℃,10 mL H2SO4
B.20℃,5 mL H2SO4,5 mL水
C.30℃,5 mL H2SO4,2 mL水
D.30℃,4 mL H2SO4,3 mL水
参考答案:C
本题解析:考查外界条件对反应速率的影响。在其他条件不变的情况下,增大反应物浓度,或升高温度均能加快反应速率,选项D中浓度最大,温度最高,反应速率最快,所以答案选C。
本题难度:一般
2、填空题 在10L的一密闭容器中,用2 mol的A和2 mol的B发生:A(g)+ 2 B(g) ?2 C(g),一小时后反应达到平衡,若此时混合气体中A和B的物质的量之和与C的物质的量相等,则A的转化率为?,B在的反应速率? ,平衡时C的体积分数为_______。
?2 C(g),一小时后反应达到平衡,若此时混合气体中A和B的物质的量之和与C的物质的量相等,则A的转化率为?,B在的反应速率? ,平衡时C的体积分数为_______。
参考答案:40%; 0.16 mol/(L·h);50%
本题解析:? A(g)+ 2 B(g) ?2 C(g)
?2 C(g)
起始量(mol)? 2? 2? 0
转化量(mol)? x?2x? 2x
平衡量(mol) 2-x? 2-2x? 2x
则2-x+2-2x=2x
解得x=0.8mol
所以A的转化率为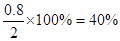
B在的反应速率是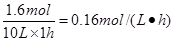
平衡时C的体积分数为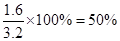
点评:该题是高考中的常见题型,属于基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该类试题需要注意的是在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某深刻的量,然后依据已知条件列式计算即可。
本题难度:一般
3、选择题 用3g块状大理石与30mL3mol/L盐酸反应制取CO2气体,若要增大反应速率且不影响CO2气体的量,可以采用的措施是
[? ]
①再加入30mL3mol/L盐酸 ②改用30mL6mol/L 盐酸 ③改用3g粉末状大理石 ④适当升高温度
A.①④
B.②③④
C.③④
D.①③④
参考答案:B
本题解析:
本题难度:一般
4、填空题 (6分)在下列事实中,请填写出是什么因素影响了化学反应的速率:
(1) 熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体_____________
(2) 将食物放入冰箱中保鲜,不易腐烂_______________________
(3) 同样大小的锌粒分别与0.1mol/LHCl和1mol/LHCl反应,反应速率不同___________
参考答案:

本题解析:略
本题难度:简单
5、填空题 t ℃时,将2 mol SO2和1 mol O2通入体积为2 L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)  2SO3(g),2 min时反应达到化学平衡,此时测得反应物O2还剩余0.8 mol,请填写下列空白:
2SO3(g),2 min时反应达到化学平衡,此时测得反应物O2还剩余0.8 mol,请填写下列空白:
(1)从反应开始到化学平衡,生成SO3的平均反应速率为________;平衡时SO2转化率为________。
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同)________。
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2n mol SO2的同时消耗n mol O2