微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用坩埚钳夹住一小块刚用酸充分处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的理解正确的是
[? ]
A.火焰温度太低不能使铝燃烧
B.铝在空气中能很快形成氧化膜
C.氧化铝的熔点比铝的熔点高
D.用酸处理时未能将氧化铝溶解
参考答案:BC
本题解析:
本题难度:简单
2、填空题 用电除尘法可除去火力发电厂烟囱中大量的粉煤灰。已知粉煤灰的主要成分如下表,从粉煤灰中能够获得Al2O3。某校研究性学习小组设计了如图所示的提取Al2O3的工艺流程图。

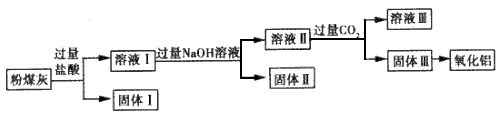
请回答下列问题。
(1)上述氧化物中能与NaOH溶液反应的是___。
(2)①固体I中含有的主要物质的化学式为__。
②向溶液Ⅱ中通人过量的CO2,发生反应的离子方程式为___。
(3)电解氧化铝制备金属铝时常常需加入冰晶石,冰晶石的作用是___,电解氧化铝的化学方程式为________,理论上从1t粉煤灰中可得到铝的质量为__。
参考答案:(1)SiO2.SO2和Al2O3
(2)①SiO2 ;
②OH-+CO2=HCO3-、? AlO2-+2H2O+CO2=Al(OH)3↓ +HCO3-
(3)使氧化铝在较低的温度下熔化;2Al2O3(熔融) 4Al+3O2↑? ;0.153 t
4Al+3O2↑? ;0.153 t
本题解析:
本题难度:一般
3、选择题 下列关于镁的性质叙述正确的是( )
A.能在空气中燃烧,但不能在二氧化碳中燃烧
B.不能与氮气发生反应
C.不与冷水反应,但与热水反应
D.可用电解氯化镁溶液的方法来制取
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列关于金属铝的叙述中,说法正确的是( )
A.Al是地壳中含量最多的元素
B.因为Al在常温下与浓硫酸不反应,所以可用铝槽车运输浓硫酸
C.与Al反应产生H2的溶液一定呈酸性
D.Al箔在空气中受热可熔化,由于氧化膜的存在,熔化的Al并不滴落
参考答案:A、地壳中元素含量最高的是氧元素,铝是地壳中元素含量最高的金属元素,故A错误;
B、Al在常温下与浓硫酸发生钝化现象,发生化学反应,生成一层致密的氧化物保护膜,阻止内部金属与浓硫酸继续反应,故B错误;
C、与Al反应产生H2的溶液可能呈酸性,也可能呈碱性,故C错误.
D、铝和氧气反应在Al箔表面生成了致密的氧化铝膜,氧化铝的熔点高于铝的熔点,加热铝箔的时铝熔化了,但是氧化铝膜兜着熔化的铝不会滴落,故D正确.
故选D.
本题解析:
本题难度:简单
5、实验题 根据Mg与CO2的反应推测,Na也能在CO2中燃烧,且固体产物可能为C、Na2O和Na2CO3中的两种或三种。某兴趣小组用如下装置开展两个阶段的实验探究。
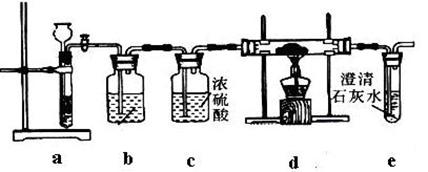
【实验I】引发CO2与Na反应。操作步骤为:
①按图连接装置,检验装置气密性,并往各装置中加入试剂;?
②打开装置a上活塞一段时间;
③点燃d处酒精灯,使CO2与Na充分反应。停止加热,继续通气体使双通管冷却。
回答下列问题:
(1)装置a中用到的玻璃仪器有试管和?;
(2)装置b中装入的试剂是 ?;
(3)装置c的作用是 ?;
(4)步骤②中,当观察到 ?时,才能进入步骤③。
【实验Ⅱ】探究反应产物及反应机理。取反应后双通管中固体物质29.2 g进行如下实验:
①仔细观察固体,发现有黑色颗粒;
②将固体溶于足量的水并过滤、洗涤,得到1.8 g滤渣(干燥);
③将滤液加水稀释配成250 mL的溶液;
④取少量③的溶液,先加足量BaCl2溶液,观察到白色沉淀,所得固体质量为3.94g;再加几滴酚酞试液,溶液变红;
⑤取25.00 mL③的溶液,滴加甲基橙作为指示剂,用3.0 mol·L-1盐酸滴定,消耗盐酸体积为20.00 mL。
回答下列问题:
(5)如何判断⑤中的滴定终点 ?
(6)反应后装置d中的固体物质为 ?;通过计算分析:29.2 g残留固体中,各组分的质量各是多少? ?
参考答案:(1)长颈漏斗(2分,多答导管不扣分)
(2)饱和NaHCO3溶液?(2分)
(3)干燥CO2(2分)
(4)e处澄清石灰水变浑浊?(2分)
(5)当滴入最后一滴盐酸时溶液恰好由黄色变为橙色,且半分钟内不变色。(2分)
(6)C、Na2O、Na2CO3(3分)C:1.8g;Na2O:6.2g;Na2CO3:21.2g(3分)
本题解析:(1)从图中可以看出a中的玻璃仪器有试管和长颈漏斗,二者构成了简易启普发生器。
(2)本题要探究的是Na在CO2中燃烧的产物,所以Na与CO2 反应位置应该在d中的硬质玻璃管中,所以CO2 从左边通入。因此a装置是CO2制取装置,实验中用盐酸和石灰石反应制取。制得的CO2 混有水蒸气和HCl气体,所以要除杂,防止其他的杂质气体与钠反应,所以b装置可以除去HCl气体,应用饱和碳酸氢钠溶液。
(3)c装置除水蒸气,干燥二氧化碳。
(4)为了防止空气中的氧气参与反应,应在反应之前先通二氧化碳气体排除空气,所以当看到e处澄清石灰水变浑浊,则说明装置已充满二氧化碳气体。
(5)因为酸滴定碱,用甲基橙作指示剂,所以滴定终点时甲基橙的颜色应该为黄色变为橙色,所以判定终点是:当滴入最后一滴盐酸时溶液恰好由黄色变为橙色,且半分钟内 91EXAM.org不变色。
(6)步骤①将固中得到1.8g滤渣(干燥)为不溶物碳。
步骤③中最终所得固体质量为3.94g为碳酸钡,说明反应生成碳酸钠,根据碳元素守恒可知,碳酸钠的物质的量=3.94g/197g/mol=0.02mol,故29.2g固体物质中n(Na2CO3)=0.02mol×250ml/25ml=0.2mol,m(Na2CO3)=0.2mol×106g/mol=21.2g。
步骤④中盐酸滴定碳酸钠,消耗盐酸的物质的量为0.02mol×2=0.04mol,实际消耗HCl为3.0mol?L-1×0.020L=0.06mol,大于0.02mol,故溶液中含有氢氧化钠,说明反应中有氧化钠生成,滴定中氢氧化钠消耗的HCl为0.06mol-0.04mol=0.02mol,根据钠离子守恒可知氧化钠的物质的量n(Na2O)=0.02mol/2=0.01mol,其质量为m(Na2O)=0.1mol×62g/mol=6.2g,且1.8g+21.2g+6.2g=29.2g,等于所取固体物质的质量,故生成为C、Na2O和Na2CO3。
本题难度:困难