微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 尿素(H2NCONH2)可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)].
(1)基态Fe3+的核外电子排布式为______.C、N、O三种元素的第一电离能由大到小的顺序是______.
(2)尿素分子中C、N原子的杂化方式分别是______.
(3)[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是______.与NO3-互为等电子体的一种化合物是______(写化学式).
(4)CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如图所示.
①1个CO2分子周围等距离且距离最近的CO2分子有______个.
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是______.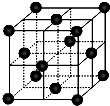
参考答案:(1)Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5,
同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半满稳定状态,能量降低,失去电子需要的能量较高,第一电离能高于同周期相邻元素,故第一电离能N>O>C,
故答案为:1s22s22p63s23p63d5;N>O>C;
(2)由尿素分子的结构式

可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,故答案为:sp2、sp3;
(3)Fe(Ⅲ)有空轨道,尿素分子中N原子含有孤对电子,H2NCONH2与Fe(Ⅲ)之间形成配位键,
N原子最外层电子数为5,将N原子及1个单位负电荷,可以替换为S原子,故SO3与NO3-互为等电子体,
故答案为:配位键;SO3等;
(4)①以顶点的二氧化碳分子研究,与之最近的二氧化碳分子位于面心上,将晶胞补全可知,有3层每各有4个二氧化碳分子与之最近,故之最近的二氧化碳分子有4×3=12,
故答案为:12;
②若顶点为Au、面心为Cu,晶胞中含有Au原子数目为8×18=1,晶胞中含有Cu原子数目为6×12=3,则铜金合金晶体中Au与Cu原子数之比为1:3,
故答案为:1:3.
本题解析:
本题难度:一般
2、填空题 有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子数总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7:8;E与B的质量比为1:1.试回答:
(1)写出基态D原子的电子排布式______.
(2)用电子式表示AE2的形成过程______,与AE2互为等电子体的离子是______.
(3)B、C两元素的第一电离能较大的元素是:______?(填写元素符号).
(4)根据VSEPR模型预测C的氢化物的立体结构为______,中心原子C的轨道杂化类型为______.
(5)C的单质中π键的数目为______,B、D两元素的气态氢化物的稳定性大小关系为:______>______?(填写化学式).
参考答案:p能级电子数不超过6,A原子最外层p能级的电子数等于次外层的电子数总数,则A的核外电子排布为1s22s22p2,应为C元素,B原子最外层中有两个不成对的电子,核外电子排布式为1s22s22p4,为O元素,B元素可分别与A、C、D、E生成RB2型化合物,且A、B、C属于同一周期,则C为N元素,可形成NO2化合物,在DB2和EB2中,D与B的质量比为7:8,则有M(D):M(O)=7:4,M(D)=7×164=28,D应为Si元素;E与B的质量比为1:1,则M(E)=2M(O)=2×16=32,所以E为S元素,
(1)D为Si元素,原子序数为14,基态原子的核外电子排布式为1s22s22p63s23p2,
故答案为:1s22s22p63s23p2;
(2)AE2为CS2,为共价化合物,根据化合物中各原子最外层满足8电子稳定结构,可写出用电子式表示的形成过程为
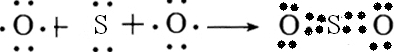
,与CS2等电子体的离子有N3-、CNO-等,
故答案为:
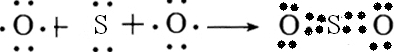
;N3-?(或CNO-);
(3)由于N原子2p轨道为半充满状态,第一电离能较大,所以第一电离能N>O,故答案为:N;
(4)NH3中,N原子与H原子形成3个δ键,孤电子对数为5-3×12=1,空间构型为三角锥形,N原子的杂化轨道类型为sp3杂化,
故答案为:三角锥形;sp3;
(5)C为N元素,形成的单质为N≡N,含有2个π键,由于O的非金属性大于Si,则稳定性:H2O>SiH4,
故答案为:2;H2O;SiH4.
本题解析:
本题难度:一般
3、选择题 下列叙述正确的是( )
A.在原子核外电子排布中,当M层是最外层时,该层最多只能排布8个电子
B.电子的能量越低,运动区域离核越远
C.短周期中次外层电子数是最外层电子数2倍的元素一定是非金属元素
D.第三周期元素的离子半径随原子序数的增加而依次减小(Ar除外)
参考答案:A
本题解析:
本题难度:简单
4、选择题 下列说法中错误的是
[ ? ]
A. 每一个能层(n)最多能容纳的电子数是2n2
B. 4d能级比3d能级可容纳的电子数多
C. 若能层序数为n,则该能层包含的能级数也为n
D. 若某短周期元素的原子最外层p能级上未成对电子数为2,则该元素可能是IVA或ⅥA族元素
参考答案:B
本题解析:
本题难度:简单
5、选择题 第?3?周期元素的基态原子中,不可能出现?1?电子,主要依据是( )
A.能量最低原理
B.近似能级图中的顺序?3d?轨道能量比?4s?轨道高
C.洪特规则
D.泡利不相容原理
参考答案:AB
本题解析:
本题难度:简单