微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 在常温下,某水溶液M中.
(1)若M中存在的离子只有:Na+、CH3COO-、H+、OH-,下列关系合理的是______.
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+)?②c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
③c(H+)>c(OH-)>c(Na+)>c(CH3COO-)?④c(Na+)=c(CH3COO-)且c(OH-)=c(H+)
(2)若M由两种相同物质的量浓度的溶液混合而成,其中只存在OH-、H+、NH4+、Cl-四种离子,且c(NH4+)>c(Cl-)>c(OH-)>c(H+),这两种溶液的溶质是______.
(3)若M为0.01mol/L的氨水,向其中加入等体积pH=2的盐酸溶液(忽略溶液体积变化),所得混合液中:c(NH4+)+c(H+)-c(OH-)=______(填数值)
(4)若已知H2A为二元弱酸,溶液M由下列三种情况:①0.01mol?L-1的H2A溶液②0.01mol?L-1的NaHA溶液③0.02mol?L-1的HCl与0.04mol?L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为______;pH由大到小的顺序为______.
(5)若M为20mL稀硫酸和盐酸混合液,向该混合酸溶液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的物质的量为0.001mol,当加入60mL?Ba(OH)2溶液时,溶液的pH=7(忽略溶液体积变化),试计算:最初混合酸溶液中c(H2SO4)=______,c(HCl)=______.
参考答案:(1)①若溶液的溶质质量醋酸钠,由醋酸根离子水解显碱性可知,c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故①正确;
②若溶液为醋酸钠和NaOH的混合物,溶液显碱性,且NaOH的物质的量远大于醋酸钠的物质的量时存在c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故②正确;
③若存在c(H+)>c(OH-)>c(Na+)>c(CH3COO-),不遵循电荷守恒,故③错误;?
④若为醋酸钠和醋酸的混合液,溶液为中性,则c(Na+)=c(CH3COO-)且c(OH-)=c(H+),故④正确;
故答案为:①②④;
(2)M由两种相同物质的量浓度的溶液混合而成,其中只存在OH-、H+、NH4+、Cl-四种离子,溶液可能为氯化铵和氨水或氯化铵和盐酸,c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液NH4Cl和NH3?H2O,故答案为:NH4Cl和NH3?H2O;
(3)M为0.01mol/L的氨水,向其中加入等体积pH=2的盐酸溶液生成0.005mol/LNH4Cl溶液,则由电荷守恒可知c(NH4+)+c(H+)-c(OH-)=c(Cl-)=0.005mol/L,
故答案为:0.005mol/L;
(4)①0.01mol?L-1的H2A溶液中,只存在电离溶液显酸性;②0.01mol?L-1的NaHA溶液中水解使溶液显碱性,③0.02mol?L-1的HCl与0.04mol?L-1的NaHA溶液等体积混合后得到0.01mol?L-1的H2A和0.01mol?L-1的NaHA,盐电离产生的HA-抑制了H2A的电离,溶液显酸性,且酸性小于①,但③的H2A分子最多,故答案为③;②③①;
(5)由Ba(OH)2+H2SO4═BaSO4↓+2H2O,
? 1?1? 1
?x?0.001mol
则c(H2SO4)=0.001mol0.02L=0.05?mol/L,
加入60mL?Ba(OH)2溶液时,溶液的pH=7,设盐酸的浓度为y,则
0.06L×0.05mol/L=0.02L×0.05?mol/L×2+0.02L×y,
解得y=0.05mol/L,即c(HCl)=0.05?mol/L,
故答案为:0.05mol/L;0.05?mol/L.
本题解析:
本题难度:一般
2、选择题 下列物质溶于水时会破坏水的电离平衡,且属于电解质的是?(?)
A.氯气
B.二氧化碳
C.醋酸钠
D.碘化钾
参考答案:C
本题解析:略
本题难度:一般
3、选择题 浓度均为0.1 mol·L-1的下列溶液,其pH由小到大的排列顺序是
①Na2CO3溶液? ②NaHSO4溶液? ③NaCl溶液? ④AlCl3溶液
A.①<②<③<④
B.①<③<④<②
C.②<④<③<①
D.④<③<②<①
参考答案:C
本题解析:试题分析:按照溶液的pH可以分成三类,酸性、碱性、中性。 ②NaHSO4溶液是酸式盐,溶液显酸性,酸性最强。④AlCl3溶液是强酸弱碱盐,水解后显示酸性;③NaCl溶液是强酸强碱盐,不水解,显示中性; ①Na2CO3溶液 是强碱弱酸盐,水解显示碱性,所以浓度均为0.1 mol·L-1的下列溶液,其pH由小到大的排列顺序是②<④<③<①?,故选C。
考点:盐的水解
点评:在此小结一下盐的水解:
⒈实质:在溶液中,由于盐电离出的离子于水电离出的离子结合生成弱电解质,从而破坏了水的电离平衡,使水的电离平衡向电离的方向移动,显示出不同浓度的酸性、碱性或中性。[1]
⒉规律:难溶不水解,有弱才水解,无弱不水解;谁弱谁水解,越弱越水解,都弱都水解;谁强显谁性,同强显中性,弱弱具体定;越热越水解,越稀越水解。
(即盐的构成中出现弱碱阳离子或弱酸根阴离子,该盐就会水解;这些离子对应的碱或酸越弱,水解程度越大,溶液的pH变化越大;水解后溶液的酸碱性由构成该盐离子对应的酸和碱相对强弱决定,酸强显酸性,碱强显碱性。)
本题难度:简单
4、选择题 下列有关电解质溶液中微粒的物质的量浓度关系正确的是
[? ]
A. 在0.1 mol/L NaHCO3溶液中:c(Na+)?> c(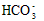 )> c(
)> c( )?> c(H2CO3)
)?> c(H2CO3)
B. 在0.1 mol/L Na2CO3溶液中:c(OH-) - c(H+)?= c(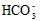 ) + c(H2CO3)
) + c(H2CO3)
C. 向0.2 mol/L NaHCO3溶液中加入等体积0.1 mol/L NaOH溶液:c( )?>c(
)?>c( )?>c(OH-)?>c(H+)
)?>c(OH-)?>c(H+)
D. 向 0.1 mol/L的CH3COONa溶液中加入等体积0.1 mol/L CH3COOH溶液:2c(H+) - c(CH3COO-) =2c(OH-) - c(CH3COOH)
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列关于电解质的说法正确的是( )
A.NaHCO3溶于水,其电离方程式为:NaHCO3=Na++HCO3-,HCO3-=H++CO32-
B.SO2的水溶液能导电,所以SO2为电解质
C.浓度均为1?mol/L的NaCl和MgSO4溶液,导电能力相同
D.强电解质溶液的导电性不一定比弱电解质溶液的导电性能强
参考答案:A.弱酸酸式盐的电离强中有弱,NaHCO3电离为Na+、HCO3-写等号,HCO3-电离写可逆号,故A错误;
B.二氧化硫的水溶液能导电,原因是二氧化硫和水反应生成亚硫酸,亚硫酸能电离出自由移动的阴阳离子而使溶液导电,亚硫酸是电解质,二氧化硫是非电解质,故B错误;
C.同浓度时,因Na+、Cl-带电荷比Mg2+、SO42-少NaCl溶液导电性比MgSO4弱,故C错误;
D.强电解质的水溶液不一定具有很强的导电能力,如硫酸钡,故D正确.
故选D.
本题解析:
本题难度:一般