微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在其它条件不变时,10℃时以某物质表示的反应速率为3 mol?(L· s )-1,已知温度每升高10℃反应速率是原来的2倍,则温度为50℃时,该反应的速率为?
A.48 mol?(L· s )-1
B.36 mol?(L· s )-1
C.24 mol?(L· s )-1
D.12 mol?(L· s )-1
参考答案:A
本题解析:
试题解析:根据题意可知从10℃升高到50℃,升高了40℃,反应速率应该升高为原来的24倍,所以50℃时的反应速率为24×3 mol?(L· s )-1=48 mol?(L· s )-1,选项A正确,答案选A。
本题难度:一般
2、填空题 把除去氧化膜的镁条投入到盛有稀盐酸的试管中,发现氢气产生速率的变化情况如图所示。
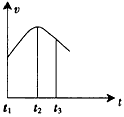
(1)在下列因素中①盐酸的浓度,②镁带的表面积,③氢气的压强,④Cl-的浓度,影响反应速率的因素有__________(填序号);
(2) t1~t2速率变化的主要原因是________________;
(3)t2~t3速率变化的主要原因是_________________。
参考答案:(1)①②
(2)反应过程中放出的热量对反应速率的影响比浓度降低的影响大,故总的反应速率增加
(3)浓度变小后,浓度对反应速率的影响成为主要因素,它使反应速率减慢
本题解析:
本题难度:一般
3、填空题 下表是某兴趣小组通过实验获得的稀硫酸与某金属反应的实验数据:
实验序号
| 金属
质量/g
| 金属
状态
| c(H2SO4)
mol/L
| V(H2SO4)
mL
| 溶液温度/℃
| 金属消失的时间/s
|
反应前
| 反应后
|
1
| 0.10
| 丝
| 0.7
| 50
| 20
| 36
| 250
|
2
| 0.10
| 丝
| 0.8
| 50
| 20
| 35
| 200
|
3
| 0.10
| 丝
| 1.0
| 50
| 20
| 35
| 125
|
4
| 0.10
| 丝
| 1.0
| 50
| 35
| 50
| 50
|
分析上述数据,回答下列问题:
(1)上述反应中,反应物的总能量比生成物的总能量 (选填“高”、“低”或“相等”)。
(2)实验1、2可得出的结论是 ;
实验3、4可得出的结论是 。
(3)若将该金属与铁用导线连接,插入盛有稀硫酸的烧杯中制作成原电池,观察到铁的表面有大量气泡。该金属的金属活动性比铁 (选填“强”或“弱”),铁电极上发生的电极反应式为 。
参考答案:(12分)
(1)高(2分);
(2)反应物浓度越大,反应速率越快(3分)
反应温度越高,反应速率越快(3分)
(3)强(2分) 2H++2e-=H2↑ (2分)
本题解析:略
本题难度:简单
4、填空题 (12分)
(1)某课外兴趣小组对H2O2的分解速率做了如下实验探究。下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)
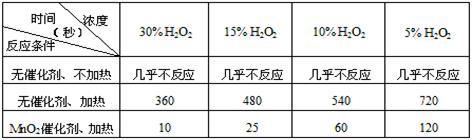
①该研究小组在设计方案时。考虑了浓度、 、 等因素对过氧化氢分解
速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对化学反应速率有何影响?
。
(2)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

①该反应的化学方程式为 ;
②从开始至2min,Z的平均反应速率为 ;2min后Z的生成速率与2min末Z的生成速率 (“是”或“否”)相等,理由是 。
参考答案:①温度、催化剂
②其他条件不变时,升高温度化学反应速率增大或加催化剂化学反应速率增大等等
(2)① 3X + Y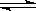 2Z; ② 0.05mol/(L·min) ; 是,2min时,反应达到了平衡,各物质的物质的量浓度不再改变,反应速率也不再改变。
2Z; ② 0.05mol/(L·min) ; 是,2min时,反应达到了平衡,各物质的物质的量浓度不再改变,反应速率也不再改变。
本题解析:(1)考查外界条件对反应速率的影响。根据反应条件可判断,在实验中主要考虑的是浓度、温度、催化剂对反应速率的影响。根据实验现象可知其他条件不变时,升高温度化学反应速率增大,使用催化剂化学反应速率增大。
(2)根据图像可判断,X、Y是反应物,Z是生成物。反应进行到2min时,X、Y、Z的变化量(mol)分别是0.3、0.1、0.2,根据变化量之比是相应的化学计量数之比可知反应的方程式为
3X + Y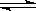 2Z。反应速率通常用单位时间内浓度的变化量来表示,所以从开始至2min,Z的平均反应速率为
2Z。反应速率通常用单位时间内浓度的变化量来表示,所以从开始至2min,Z的平均反应速率为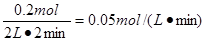 。由图像可判断,反应进行到2min时,各种物质的物质的量均不再随时间变化而变化,所以反应达到化学平衡状态,因此2min后Z的生成速率与2min末Z的生成速率是相等的。
。由图像可判断,反应进行到2min时,各种物质的物质的量均不再随时间变化而变化,所以反应达到化学平衡状态,因此2min后Z的生成速率与2min末Z的生成速率是相等的。
本题难度:困难
5、填空题 在硫酸工业中,通过下列反应使SO2转化为SO3:2SO2+O2 2SO3,ΔH<0,已知常压下平衡混合气体中SO3体积分数为91%。试回答:?
2SO3,ΔH<0,已知常压下平衡混合气体中SO3体积分数为91%。试回答:?
(1)在生产中常用过量的空气是为了____________________________________。
(2)加热到400℃~500℃是由于_____________________________________。
(3)压强采用______________,原因是__________________________________。
(4)常用浓H2SO4来吸收SO3而不用水,因为____________________________。
参考答案:(1)增大氧气浓度,提高成本较高的SO2的转化率?
(2)在此温度下,催化剂活性强,反应速率快,可缩短到达平衡的时间,提高单位时间内SO3的产率?
(3)常压?因常压下平衡混合气体中SO3的体积分数已达91%,若再加压,对设备动力系统要求高,成本高,加压已无实际意义?
(4)用水吸收易形成酸雾,降低吸收速率;防止空气污染。
本题解析:(1)增大氧气浓度,即增大反应物的浓度,促使平衡向正反应方向移动,从而提高成本较高的SO2的转化率。
(2) 因为在此温度下,催化剂活性强,反应速率快,可缩短到达平衡的时间,提高单位时间内SO3的产率,所以温度控制在400℃~500℃。
(3)由于在常压下平衡混合气体中SO3的体积分数已达91%,若再加压,对设备动力系统要求高,成本高,加压已无实际意义,因此采用常压。
(4)由于用水吸收易形成酸雾,降低吸收速率,且容易造成空气污染,所以常用浓H2SO4来吸收SO3而不用水。
点评:本题是基础性知识的考查,难度不大。该题主要是检验学生对工业制取浓硫酸的熟悉理解掌握程度,引导学生重视基础,增强学生的环境保护意识,提高学生的学习兴趣。
本题难度:一般