微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 盖斯定律指出:化学反应的焓变只与各反应物的始态和各生成物的终态有关,而与具体的反应途径无关。物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是
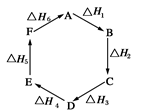
A.A→F,ΔH=-ΔH6
B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1
C.C→F,|ΔH|=|ΔH1+ΔH2+ΔH6|
D.|ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6|
参考答案:B
本题解析:试题分析:从反应图像来看,ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6表示从A又回到A,整个过程中没有能量变化,所以ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0,B项错误,答案选B。
考点:盖斯定律
点评:化学反应中的能量变化只与反应物和产物的状态有关,与反应的路径无关。
本题难度:困难
2、填空题 (12分)填空题
(1)金属钙在一定条件下可以与氢气化合生成CaH2(白色固体)。将该白色固体加入滴有酚酞的蒸馏水中,可以观察到有气泡生成,溶液变红。请根据以上事实书写CaH2与水反应的化学方程式_____________________________________。
(2)实验室可用MnO2+4HCl(浓)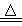 MnCl2+Cl2↑+2H2O制备氯气,请回答以下问题:
MnCl2+Cl2↑+2H2O制备氯气,请回答以下问题:
①该反应的还原剂是 ,氧化剂与还原剂的物质的量比是______________。被氧化的元素是_______________,还原产物是 。
②若反应中转移了NA个电子,则生成的Cl2在标准状况下的体积是 。
③实验室用12.00 mol/L盐酸配制100mL 1 mol/L 盐酸,需要的玻璃仪器除了烧杯、量筒、玻璃棒,还有____________。若定容时俯视刻度线,则配得溶液的浓度___________(填“偏高”,“偏低”,“不变”)。
参考答案:(1)CaH2 + 2H2O = Ca(OH)2 + 2H2↑ (2分)
(2)①HCl 1:2 Cl MnCl2(1×4=4分)
②11.2L (2分)
③100mL容量瓶、胶头滴管(1×2=2分) 偏高(2分)
本题解析:(1)根据现象分析,溶液变红,说明有碱性物质生成,有气泡生成说明有气体生成,氢化钙中的氢元素化合价为-1,和水的氢元素+1发生氧化还原反应生成氢气,所以氢化钙和水反应生成氢氧化钙和氢气,方程式为:CaH2 + 2H2O = Ca(OH)2 + 2H2↑。(2)①反应中盐酸中的氯元素化合价升高,做还原剂,二氧化锰中的锰元素化合价降低,每摩尔二氧化锰得电子需要2摩尔盐酸失去电子,所以氧化剂和还原剂的物质的量比为1:2;盐酸中的氯元素化合价升高被氧化,二氧化锰中锰元素化合价降低,被还原生成氯化锰是还原产物。②每生成1摩尔氯气转移2摩尔电子,所以转移1摩尔电子时生成0.5摩尔氯气,标准状况下体积为11.2L。③配制100毫升溶液必须用100mL容量瓶还用胶头滴管;定容时俯视,溶液的体积偏小,则配制的浓度偏高。
考点:氯气的制取,一定物质的量浓度的溶液的配制。
本题难度:一般
3、选择题 50ml 18.4mol/L硫酸与足量的铜片加热反应,被还原的硫酸的物质的量是
A.0.92mol
B.大于0.46mol, 小于0.92mol
C.0.46mol
D.小于0.46mol