微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列对化学反应限度的叙述中错误的是
[? ]
A.任何可逆反应在给定条件下都有一定的限度
B.化学反应达到限度时,正、逆反应速率相等
C.化学反应的限度与时间的长短无关
D.化学反应的限度不随外界条件的改变而改变
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列叙述中正确的是( )
A.在稀溶液中1mol酸和1mol碱完全反应所放出的热量,叫做中和热
B.在101kPa时1mol物质燃烧时的反应热叫做该物质的标准燃烧热
C.热化学方程式中,各物质前的化学计量数不表示分子个数
D.如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应
参考答案:C
本题解析:
本题难度:简单
3、简答题 (1)在岩洞、钟乳石的形成过程中包含下列反应:
CaCO3(s)+H2O(l)+CO2(g)?Ca2+(aq)+2HCO3-(aq)△H=-321.7kJ/mol
①写出该反应的平衡常数表达式:K=______
②Ca(HCO3)2?溶液中的?c(OH-)?与c(H+)、c(H2CO3)、c(CO32-)之间的关系为:c(OH-)=______
(2)美丽的珊瑚和珍珠的主要成分都是碳酸钙,而便宜的“珊瑚礁”是用石膏(CaSO4?2H2O)制成的,请设计一个简单的实验方案区分真假珊瑚礁:______.
(3)锅炉水垢中含有的CaSO4,可先用碳酸钠溶液处理,使之转化为疏松、易溶于酸的物质,该转化的离子方程式是______.
参考答案:(1)①CaCO3(s)+H2O(l)+CO2(g)?Ca2+(aq)+2HCO3-(aq)平衡常数k=c(Ca2+)×c2(HCO3-)c(H2O)×c(CO2),
故答案为:c(Ca2+)×c2(HCO3-)c(H2O)×c(CO2);
②溶液中存在H2O?H++OH-,HCO3-?H++CO32-,HCO3-+H2O?OH-+HCO3-,溶液氢氧根来源于水的电离,与碳酸氢根的水解,水电离的氢氧根浓度为c(H+)-c(CO32-),碳酸氢根水解得到氢氧根浓度等于碳酸的浓度,故溶液中c(OH-)=c(H+)+c(H2CO3)-c(CO32-),
故答案为:c(OH-)=c(H+)+c(H2CO3)-c(CO32-);
(2)通过检验是否含有碳酸根,进行鉴别,具体操作:取少量待检珊瑚礁于试管中,加入足量稀盐酸,若放出大量能使澄清石灰水变浑浊的无色气体,珊瑚礁为真,否则为假,
故答案为:取少量待检珊瑚礁于试管中,加入足量稀盐酸,若放出大量能使澄清石灰水变浑浊的无色气体,珊瑚礁为真,否则为假;
(3)水垢中含有的CaSO4,先用碳酸钠溶液处理,转化为?CaCO3,转化的离子方程式是CaSO4(s)+CO32-?(aq)?CaCO3(s?)+SO42-?(aq),
故答案为:CaSO4(s)+CO32-?(aq)?CaCO3(s?)+SO42-?(aq).
本题解析:
本题难度:一般
4、填空题 (14分)为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.煤综合利用的一种途径如下所示:
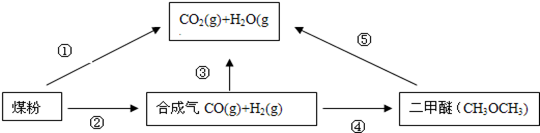
(1)已知:C(s)+H2O(g)====CO(g)+H2(g) △H1=+131.3kJ?mol-1
C(s)+2H2O(g)====CO2(g)+2H2(g) △H2=+90kJ?mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);ΔH
CH3OCH3(g)+3H2O(g);ΔH
①该反应平衡常数表达式为K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。
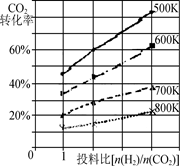
该反应的ΔH________(填“>”、“<”或“=”)0。若温度不变,减小反应投料比[n(H2) /n(CO2)],则K将________(填“增大”、“减小”或“不变”)。
(3)一种新型氢氧燃料电池工作原理如下图所示。
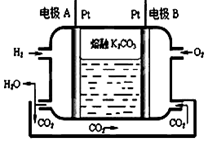
①写出电极A的电极反应式 放电过程中,溶液中的CO32-将移向电极 (填A或B)
②以上述电池电解饱和食盐水,若生成0.2mol Cl2,则至少需通入O2的体积为 L(标准状况)
参考答案:(每空2分,共14分)
(1)CO(g)+H2O(g)====CO2(g)+H2(g) △H=-41.3kJ?mol-1;
(2)① c(CH3OCH3)×c3(H2O)]/[c2(CO2)×c6(H2) ② < 不变
(3)①H2-2e-+CO32-= CO2+ H2O;A
②2.24
本题解析:(1)根据盖斯定律得,一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为CO(g)+H2O(g)====CO2(g)+H2(g) △H=△H2-△H1=+90kJ?mol-1-131.3kJ?mol-1=-41.3kJ?mol-1;
(2)①根据平衡常数的定义,该反应的平衡常数K= c(CH3OCH3)×c3(H2O)]/[c2(CO2)×c6(H2);
②根据图像可知,随温度升高,二氧化碳的转化率降低,说明升高温度,平衡逆向移动,所以正反应是放热反应,ΔH<0;平衡常数只与温度有关,若温度不变, 减小反应投料比[n(H2) /n(CO2)],则K将不变;
(3)①电极A通入氢气,发生氧化反应,所以A是负极,氢气失去电子,与碳酸根离子结合为水和二氧化碳气体,电极反应式为:H2-2e-+CO32-= CO2+ H2O;原电池中,阴离子向负极移动,则碳酸根离子向A极移动;
②生成0.2mol Cl2,则转移0.4mol电子,根据O2+4e-+2CO2=2CO32-,则需要氧气的物质的量是0.1mol,标准状况下的体积是0.1mol×22.4L/mol=2.24L。
考点:考查盖斯定律的应用,平衡常数的表示及判断,原电池反应原理的应用
本题难度:困难
5、填空题 碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。已知
①2CH4(g)+3O2(g)=2CO(g)+4H2O(1); △H1=-1214.6 kJ/mol
②2CO(g)+O2(g)=2CO2(g); △H2=-566 kJ/mol
则反应CH4(g)+2O2(g)=CO2(g)+2H2O(1)的△H=_______________。
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其正极电极反应式是:____________________
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
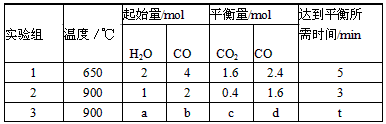
①实验1中,以v(H2)表示的平均反应速率为____________;
②该反应的正反应为_______(填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是
_____________(用含a、b的数学式表示)。
参考答案:(1)-890. 3 kJ/mol
(2)O2 +4e- +2H2O=4OH-
(3)①0.16mol/(L·min);②放;③a:b=1:2(或b=2a)
本题解析:
本题难度:一般