微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在水溶液中,YO3n—和S2-发生反应的离子方程式如下:
YO3n—+3S2-+6H+===Y-+3S↓+3H2O
(1)YO3n—中Y元素的化合价是________。
(2)Y元素原子的最外层电子数是________。
(3)比较S2-和Y-的还原性强弱________________。
参考答案:+5? (2分) 7? (2分)? S2->Y-(2分)
本题解析:根据方程式可知,Y的最低价是-1价,所以属于第ⅦA,最外层电子数是7个。YO3n—中Y元素的化合价是+(2×3-1)=+5价。氧化还原反应中,还原剂的还原性大于还原产物的,所以S2-和Y-的还原性强弱是S2->Y-。
本题难度:一般
2、选择题 下列各项中表达正确的是(?)
A.CO2的分子模型:
B.F—结构示意图: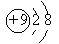
C.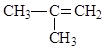 2-甲基-2-丙烯
2-甲基-2-丙烯
D.HCl的电子式为: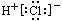
参考答案:B
本题解析:A:CO2为直线型分子,不正确
B:正确
C:应从碳碳双键近的一端编号,不正确
D:HCl为共价化合物,不正确
本题难度:一般
3、填空题 标准状况下336 L的NH3溶于1 L水中,所得溶液的质量分数为________,若该溶液的密度为a g/cm3,则物质的量浓度为________。将上述氨水全部转化为NH4Cl,所需4 mol·L-1的盐酸的体积为________。
参考答案:20.32% 11.95a mol·L-1 3.75 L
本题解析:氨水的质量分数
w=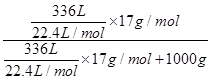 ×100%=20.32%。
×100%=20.32%。
氨水的物质的量浓度
c(NH3)= =11.95a mol·L-1。
=11.95a mol·L-1。
NH3+HCl=NH4Cl
n(NH3)= =15 mol,
=15 mol,
n(HCl)=15 mol,
V(HCl)=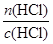 =
=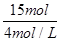 =3.75 L。
=3.75 L。
本题难度:简单
4、选择题 6.4g铜与足量的浓硝酸反应(假设硝酸的还原产物只有一种),生成的气体被饱和的氢氧化钠溶液完全吸收,生成NaNO3和NaNO2,则亚硝酸钠的物质的量为( )
A.0.2mol
B.0.3mol
C.0.1mol
D.0.5mol
参考答案:C
本题解析:
本题难度:简单
5、填空题 (6分)铁丝在氯气中点燃发生反应:2Fe + 3Cl2  2FeCl3,其中氯元素的化合价_______(填“升高”或“降低”),氯元素被____ _____(填“氧化”或“还原”);Fe做_____ ____剂,具有 性。在该反应中,若消耗了1 mol Fe,则生成___ ____mol FeCl3,转移 mol电子。
2FeCl3,其中氯元素的化合价_______(填“升高”或“降低”),氯元素被____ _____(填“氧化”或“还原”);Fe做_____ ____剂,具有 性。在该反应中,若消耗了1 mol Fe,则生成___ ____mol FeCl3,转移 mol电子。
参考答案:(6分)(每空1分)
降低, 还原, 还原 , 还原。1 ,3 。
本题解析:根据2Fe + 3Cl2  2FeCl3反应,Cl元素的化合价反应前是0价,反应后是-1价,所以反应后降低;化合价降低,被还原;Fe元素的化合价反应前是0价,反应后是+3价,化合价升高,被氧化,作还原剂;具有还原性;在该反应中,若消耗了1 mol Fe,则生成1mol FeCl3,1个Fe失去3个电子,所以1molFe失去3mol电子,所以共转移3mol电子。
2FeCl3反应,Cl元素的化合价反应前是0价,反应后是-1价,所以反应后降低;化合价降低,被还原;Fe元素的化合价反应前是0价,反应后是+3价,化合价升高,被氧化,作还原剂;具有还原性;在该反应中,若消耗了1 mol Fe,则生成1mol FeCl3,1个Fe失去3个电子,所以1molFe失去3mol电子,所以共转移3mol电子。
考点:考查氧化还原反应的分析,还原剂、氧化剂的判断,转移电子数的判断
本题难度:一般