微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氨气能发生氧化反应:4NH3+5O2=4NO+6H2O,改变下列条件使反应速率加大,其中是由于增大了“活化分子”的百分数的是
A.增加NH3浓度
B.升高温度
C.缩小体积增大压强
D.降低温度
参考答案:B
本题解析:浓度和压强只能增大单位体积内活化分子的百分数,而不能增大活化分子的百分数,升高温度和使用催化剂是可以的,因此正确的答案选B。
本题难度:简单
2、选择题 为了探究温度对化学反应速率的影响,下列实验方案可行的是( )
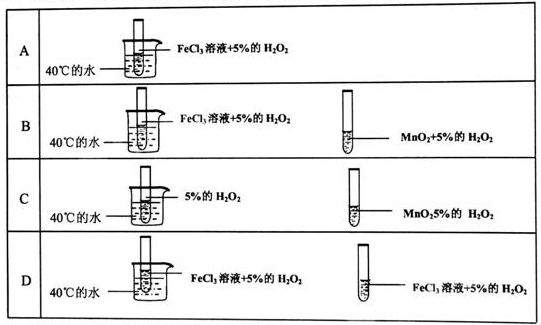
A.A
B.B
C.C
D.D
参考答案:A、没有参照物,所以无法判断,故A错误.
B、催化剂、温度都不同,所以无法判断,故B错误.
C、两个实验的影响因素不同,所以无法判断,故C错误.
D、两个实验的不同点只有温度,所以能判断温度对化学反应速率的影响,故D正确.
故选D
本题解析:
本题难度:简单
3、选择题 对于反应2SO2(g)+O2(g)?2SO3(g);△H<0能增大正反应速率的措施是( )
A.通入大量O2
B.增大容器容积
C.通入大量SO3
D.降低体系温度
参考答案:A、通入大量氧气,增大反应物的浓度,能增大正反应速率,故A正确;
B、增大容器容积,减小了体系的压强,压强减小,正反应速率减小,故B错误;
C、通入三氧化硫,生成物的浓度增大,正、逆反应速率都增大,故C正确;
D、降低体系的温度,正逆反应速率都减小,故D错误.
故选AC.
本题解析:
本题难度:简单
4、选择题 某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为
实验编号
| 反应物
| 催化剂
|
①
| 10 mL 2% H2O2溶液
| 无
|
②
|
| 无
|
③
| 10 mL 5% H2O2溶液
| MnO2固体
|
A.5 mL 2% H2O2溶液 B.10 mL 5% H2O2溶液
C.10 mL 2% H2O2溶液 D.5 mL 10% H2O2溶液
参考答案:B
本题解析:根据定一议二的原则可知,在实验①②中均没有使用催化剂,因此改变的条件应该是双氧水的浓度。由于所以③中使用了催化剂,所以实验②③中改变的条件是催化剂,这说明实验②中反应物与实验③中反应物完全相同,所以实验②的反应物应该是10 mL 5% H2O2溶液,答案选B。
考点:考查外界条件对反应速率影响的实验探究
本题难度:一般
5、选择题 对于100mL1mol/L硫酸与足量的铝片反应,采取下列措施能使反应速率加快且H2的产量不变的是:①升高温度;②改用100mL18mol/L硫酸;③改用100mL2mol/L硝酸;④用足量铝粉代替铝片;⑤滴入少量CuSO4溶液( )
A.①③⑤
B.①④⑤
C.②③⑤
D.①②④
参考答案:①升高温度,使反应速率加快且H2的产量不变,故正确;
②改用100mL18mol/L硫酸,发生氧化还原反应不生成氢气,故错误;
③改用100mL2mol/L硝酸,发生氧化还原反应不生成氢气,故错误;
④用足量铝粉代替铝片,增大接触面积,使反应速率加快且H2的产量不变,故正确;
⑤滴入少量CuSO4溶液,构成原电池,使反应速率加快且H2的产量不变,故正确;
故选B.
本题解析:
本题难度:一般